Đề ôn tập giữa học kì 2 lớp 10 môn hóa học
ĐÁP ÁN
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án. Mỗi câu trả lời đúng được 0,25 điểm
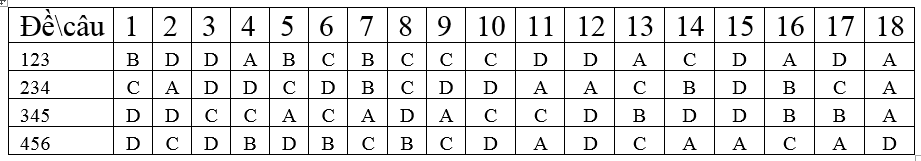
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 4.Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai. (Đ – S). Điểm tối đa của 01 câu hỏi là 1 điểm
– Thí sinh chỉ lựa chọn chính xác 01 ý trong 1 câu hỏi được 0,1 điểm
– Thí sinh chỉ lựa chọn chính xác 02 ý trong 1 câu hỏi được 0,25 điểm
– Thí sinh chỉ lựa chọn chính xác 03 ý trong 1 câu hỏi được 0,5 điểm
– Thí sinh lựa chọn chính xác cả 04 ý trong 1 câu hỏi được 1 điểm
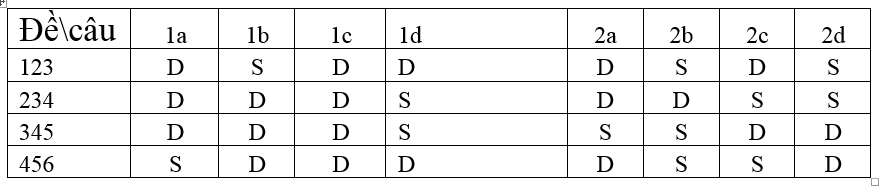
PHẦN III: Câu hỏi trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 6.
Mỗi câu trả lời đúng được 0,25 điểm
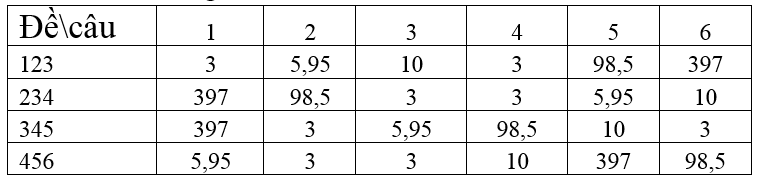
PHẦN IV: Tự luận
Câu 1: Cân bằng phương trình sau bằng phương pháp thăng bằng electron, chỉ rõ chất oxi hóa, chất khử?
CO + Fe2O3 → CO2 + Fe
Xác định số oxi hóa 0,25
Viết 2 quá trình 0,25
Hoàn thành cân bằng 0,5

ĐỀ BÀI
| NĂM HỌC 2024 – 2025 ĐỀ CHÍNH THỨC | ĐỀ KIỂM TRA CHẤT LƯỢNG GIỮA HỌC KỲ II MÔN: HOÁ HỌC – LỚP 10 Thời gian làm bài: 50 phút (không kể thời gian giao đề) Đề thi gồm 04 trang MÃ ĐỀ 123 |
Họ, tên thí sinh: ………………………………………………………………..
Số báo danh: …………………………………………………………………….
Cho biết nguyên tử khối (theo amu) của các nguyên tố:
H = 1; He = 4; Li = 7; Be = 9; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; P = 31; S = 32; Cl = 35,5; K = 39; Ca = 40, Cu = 64, Zn =65, Br = 80, Ag = 108.PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1. Số oxi hóa của đơn chất luôn bằng
A. -1. B. 0 C. +1 D. -2
Câu 2. Chất nào sau đây có nhiệt tạo thành chuẩn khác 0?
A. N2(g). B. S(s). C. Na(s). D. SO2(g)
Câu 3. Điền vào chỗ trống.
Biểu thức tính biến thiên enthalpy của phản ứng ở đk chuẩn theo năng lượng liên kết là
A. , B. , .
C. , . D. , .
Câu 4. Phản ứng hóa học nào sau đây không phải phản ứng oxi hóa – khử?
A. Al(OH)3 Al2O3 + H2O. B. C + O2 CO2.
C. 2Na + H2O → 2NaOH + H2. D. C + CO2 2CO
Câu 5. Số oxi hóa của nguyên tử S trong hợp chất SO2 là
A. +2. B. +4. C. +6. D. -1.
Câu 6. Phương trình hóa học nào dưới đây biểu thị enthalpy tạo thành chuẩn của CO(g)?
A. 2C (than chì) B. C (than chì) +
C. C (than chì) D. C (than chì)
Câu 7. Cho phương trình nhiệt hóa học: 3H2(g) + N2(g) 2NH3(g) = -91,80kJ
Lượng nhiệt tỏa ra khi dùng 9 g H2(g) để tạo thành NH3(g) là
A. 275,40 kJ. B. 137,70 kJ. C. 45,90 kJ. D. 183,60 kJ.
Câu 8. Dựa vào phương trình nhiệt hóa học của phản ứng sau:
CO2(g) CO(g) + O2(g) = +280 kJ
Giá trị của phản ứng: 2CO2(g) 2CO(g) + O2(g) là
A. +140 kJ. B. -1120 kJ. C. +560 kJ. D. -420 kJ.
Câu 9. Điều kiện nào sau đây là điều kiện chuẩn đối với chất khí?
A. Áp suất 1 bar và nhiệt độ 298oC.
B. Áp suất 1 bar và nhiệt độ 25K.
C. Áp suất 1 bar và nhiệt độ 25oC.
D. Áp suất 25 bar và nhiệt độ 1oC.
Câu 10. Biến thiênenthalpy của phản ứng là
A. Nhiệt lượng cần cung cấp cho phản ứng.
B. Nhiệt lượng tỏa ra của phản ứng ở điều kiện xác định.
C. Nhiệt lượng tỏa ra hay thu vào của phản ứng ở điều kiện xác định.
D. Nhiệt lượng thu vào của phản ứng ở điều kiện xác định.
Câu 11. Cho phương trình nhiệt hóa học:
3H2(g) + N2(g) 2NH3(g) = -91,80kJ
Nhiệt tạo thành NH3(g) ở điều kiện chuẩn là
A. + 45,90 kJ. B. -91,80 kJ. C. 91,8 0 kJ. D. -45,90 kJ.
Câu 12. Kí hiệu biến thiên enthalpy của phản ứng ở điều kiện chuẩn là
A. . B. . C. . D. .
Câu 13. Sản xuất gang trong công nghiệp bằng cách sử dụng khí CO khử Fe2O3 ở nhiệt độ cao theo phản ứng sau: Fe2O3 + 3CO 2Fe + 3CO2. Trong phản ứng trên chất đóng vai trò chất khử là
A. CO. B. Fe2O3. C. Fe. D. CO2.
Câu 14. Phản ứng tỏa nhiệt có
A. ∆rH ≥ 0. B. ∆rH = 0. C. ∆rH < 0. D. ∆rH > 0.
Câu 15. Trong phản ứng cháy, chất cháy thường là nhiên liệu (than đá, xăng, …), chất oxi hóa thường là
A. Nitrogen. B. Carbon. C. Hydrogen. D. Oxygen.
Câu 16. Phản ứng chuyển hóa giữa hai dạng đơn chất của phosphorus (P):
P (s, đỏ) P (s, trắng)
Điều này chứng tỏ phản ứng:
A. thu nhiệt, P đỏ bền hơn P trắng. B. thu nhiệt, P trắng bền hơn P đỏ.
C. tỏa nhiệt, P đỏ bền hơn P trắng. D. tỏa nhiệt, P trắng bền hơn P đỏ.
Câu 17. Quá trình C ® C+4 + 4e là quá trình
A. khử. B. thu nhiệt C. nhận proton. D. oxi hóa.
Câu 18. Phân tử hemoglobin (Hb) trong máu nhận O2 ở phổi để chuyển thành HbO2. Chất này theo máu tới các bộ phận cơ thể, tại đó HbO2 lại chuyển thành Hb và O2 (để cung cấp O2 cho các hoạt động sinh hoá cần thiết trong cơ thể). Nếu trong không khí có lẫn carbon monoxide (CO), cơ thể nhanh chóng bị ngộ độc. Cho các số liệu thực nghiệm sau:
Hb + O2 HbO2 r = = -33,05 kJ (1)
Hb + CO HbCO r = = -47,28 kJ (2)
HbO2 + CO HbCO + O2 r = = -14,23 kJ (3)
HbCO + O2 HbO2 + CO r = = 14,23 kJ (4)
Xét về mặt năng lượng thì phản ứng nào ở trên diễn ra thuận lợi nhất?
A. (2). B. (3). C. (1). D. (4).
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 4.Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai. (Đ – S)
Câu 1. Cho phương trình nhiệt hóa học:
Zn (s) + CuSO4 (aq) ZnSO4 (aq) + Cu (s)
a) Trong phản ứng trên, Zn là chất khử.
b) Phản ứng trên thu nhiệt.
c) Hòa tan hết 1 mol Zn trong dung dịch CuSO4 nhiệt lượng tỏa ra là 210 kJ
d) Phản ứng trên là phản ứng oxi hóa khử.
Câu 2. Cho hai phương trình nhiệt hóa học sau:
- CO (g) + O2 (g) CO2 (g) = – 283,00 kJ
- C2H5OH (l) + O2(g) 2CO2(g) + 3H2O (l) = – 1366,89 kJ
a) Khi đốt cháy cùng 1 mol CO và C2H5OH thì phản ứng (2) tỏa ra lượng nhiệt lớn hơn phản ứng (1).
b) Phương trình (1) là phương trình nhiệt tạo thành CO2(g).
c) Trong cả hai phản ứng thì O2 là chất oxi hóa.
d) Đốt cháy 0,5 kg C2H5OH thì tỏa ra nhiệt lượng là 14,8575 kJ
PHẦN III: Câu hỏi trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 1. Các quá trình sau:
(a) Đốt một ngọn nến.
(b) Nước đóng băng.
(c) Hòa tan muối ăn vào nước thấy cốc nước trở nên mát.
(d) Hòa tan một ít bột giặt trong tay với nước, thấy tay ấm.
Có bao nhiêu quá trình là tỏa nhiệt?
Câu 2. Xét phản ứng trong giai đoạn đầu của quá trình Ostwald:
NH3 + O2 → NO + H2O
Trong công nghiệp, cần trộn 1 thể tích khí ammonia với bao nhiêu thể tích không khí để thực hiện phản ứng trên? Biết không khí chứa 21% thể tích oxygen và các thể tích khí đo ở cùng điều kiện nhiệt độ và áp suất. (làm tròn kết quả đến hàng phần trăm)
Câu 3. Ion Ca2+ cần thiết cho máu của người hoạt động bình thường. Nồng độ ion calcium không bình thường là dấu hiệu của bệnh. Để xác định nồng độ ion calcium, người ta lấy mẫu máu, sau đó kết tủa ion calcium dưới dạng calcium oxalate (CaC2O4) rồi cho calcium oxalate tác dụng với dung dịch potassium penmanganate (KMnO4) trong môi trường acid theo phản ứng sau:
CaC2O4 + KMnO4 + H2SO4 → CaSO4 + K2SO4 + MnSO4 + CO2↑ + H2O
Giả sử calcium oxalate kết tủa từ 1 mL máu một người tác dụng vừa hết với 2,05 mL dung dịch KMnO4 4,88.10-4 M. Nồng độ ion calcium trong máu người đó bằng bao nhiêu mg Ca2+/100 mL máu? (làm tròn kết quả đến hàng đơn vị)
Câu 4. Cho các phương trình nhiệt hóa học sau:
(1) N2 (g) + 3H2 (g) 2NH3 (g)
(2) H2 (g) + I2 (g) 2HI (g)
(3) Zn (s) + CuSO4 (aq) ZnSO4 (aq) + Cu (s)
(4) HCl (aq) + NaOH (aq) NaCl (aq) + H2O (l)
Có bao nhiêu phản ứng là phản ứng tỏa nhiệt?
Câu 5. Phản ứng giữa sulfur dioxide và oxygen là tỏa nhiệt
2SO2 (g) + O2 (g) 2SO3 (g) = -197kJ
Giá trị biến thiên enthalpy chuẩn của phản ứng SO3 (g) SO2 + O2 (g) là bao nhiêu? (Làm tròn kết quả đến hàng phần mười)
Câu 6. Dung dịch glucose (C6H12O6) 5%, có khối lượng riêng là 1,02 g/mL, phản ứng oxi hóa 1 mol glucose tạo thành CO2 (g) và H2O (l) tỏa ra nhiệt lượng là 2803,0 kJ.
Một người bệnh được truyền một chai nước chứa 500 mL dung dịch glucose 5%. Năng lượng tối đa từ phản ứng oxi hóa hoàn toàn glucose mà bệnh nhân đó có thể nhận được là bao nhiêu? (làm tròn kết quả đến hàng đơn vị)
PHẦN IV: Tự luận
Câu 1: Cân bằng phương trình sau bằng phương pháp thăng bằng electron, chỉ rõ chất oxi hóa, chất khử?
CO + Fe2O3 → CO2 + Fe
Câu 2: Methane là thành phần chính của khí thiên nhiên. Xét phản ứng đốt cháy methane:
CH4 (g) + 2O2 (g) CO2 (g) + 2H2O (l)
Biết nhiệt tạo thành chuẩn của CO2 (g) và H2O (l) tương ứng là -393,5 kJ/mol và -285,8 kJ/mol.
Hãy tính nhiệt tạo thành chuẩn của khí methane?
Leave a Reply