Đề thi hsg môn hóa lớp 10 THPT Chuyên Lê Khiết Quảng Ngãi năm 2023 2024




O2 Education gửi các thầy cô link download đề thi
Các thầy cô có thể xem thêm nhiều đề thi hsg của các tỉnh khác tại
Tổng hợp đề thi hsg lớp 10 môn hoá học
Đề thi hsg môn hóa lớp 10 THPT Chuyên Lê Khiết Quảng Ngãi năm 2023 2024





O2 Education gửi các thầy cô link download đề thi
Các thầy cô có thể xem thêm nhiều đề thi hsg của các tỉnh khác tại
Tổng hợp đề thi hsg lớp 10 môn hoá học
Đề thi hsg môn hóa lớp 10 THPT A Kim Bảng Hà Nam năm 2023 2024
| SỞ GIÁO DỤC VÀ ĐÀO TẠO HÀ NAM TRƯỜNG THPT A KIM BẢNG (Đề thi có 02 trang) | KỲ THI CHỌN HỌC SINH GIỎI CẤP TỈNH NĂM HỌC 2023– 2024 Môn thi: Hóa học 10 ( Thời gian làm bài: 180 phút) |
Câu 1 (2 điểm): Cho 3 hydrocarbon X, Y, Z đều có 2 nguyên tử C trong phân tử. Số nguyên tử H trong các phân tử tăng dần theo thứ tự X, Y, Z.
a. Viết công thức cấu tạo của X, Y, Z.
b. Viết phương trình đốt cháy hoàn toàn X, Y, Z với hệ số nguyên tối giản.
c. Tính biến thiên enthalpy của mỗi phản ứng dựa vào enthalpy tạo thành chuẩn trong bảng sau:
| Chất | X(g) | Y(g) | Z(g) | CO2(g) | H2O(g) |
| +227,0 | +52,47 | –84,67 | –393,5 | –241,82 |
d. Từ kết quả tính toán đưa ra kết luận về ứng dụng của phản ứng đốt cháy X, Y, Z trong thực tiễn.
Câu 2 (2,5 điểm):
1. Đường sucrose (C12H22O11) là một đường đôi. Trong môi trường acid ở dạ dày và nhiệt độ cơ thể, sucrose bị thủy phân thành đường glucose và fructose, sau đó bị oxy hóa bởi oxygen tạo thành CO2 và H2O. Sơ đồ thay đổi năng lượng hóa học của phản ứng được cho như hình dưới đây:
a. Dựa theo đồ thị, hãy cho biết phản ứng trong đó là tỏa nhiệt hay thu nhiệt. Vì sao?
b. Viết PTHH của phản ứng thủy phân đường sucrose. Phản ứng trong sơ đồ có phải là phản ứng oxi hóa – khử hay không?
c. Khi 1 mol đường sucrose bị đốt cháy hoàn toàn với một lượng vừa đủ oxygen ở điều kiện chuẩn tỏa ra một lượng nhiệt là 5645 kJ. Xác định biến thiên enthalpy chuẩn của phản ứng oxi hóa sucrose.
d. Nếu 5,00 gam đường sucrose được đốt cháy hoàn toàn ở cùng điều kiện như trên thì biến thiên enthalpy quá trình bằng bao nhiêu?
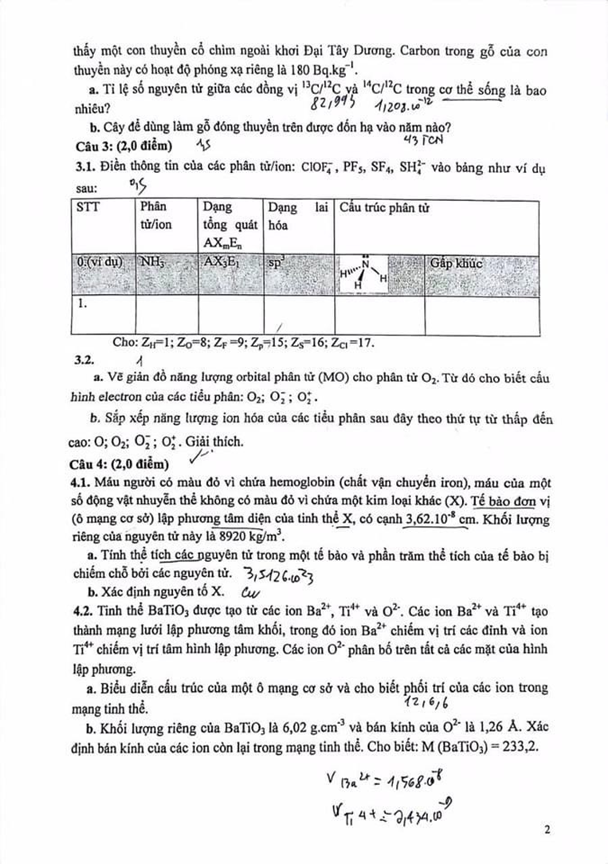
2. 14C là một đồng vị phóng xạ β của cacbon có chu kì bán hủy t1/2 = 5700 năm. Hàm lượng 14C trong khí quyển và trong cơ thể sinh vật sống luôn ổn định. Khi các sinh vật chết, tỉ lệ giảm dần. Mỗi gam cacbon tổng cộng trong cơ thể sống có độ phóng xạ của 14C bằng 0,277 Bq (phân rã/giây).
a. Nguyên tử 14C biến đổi ra sao sau khi phân rã?
b. Một mẫu vật có nguồn gốc sinh học có tỉ lệ bằng 0,25 lần tỉ lệ trong cơ thể sống. Tính tuổi mẫu vật.
Câu 3: (2,5 điểm)
1. Chlorine (Z=17) thường được sử dụng để khử trùng nước máy trong sinh hoạt. Trong tự nhiên nguyên tố Chlorine có hai đồng vị là và với nguyên tử khối trung bình là 35,48. Trong một hợp chất FeClx có chứa 41,78% khối lượng đồng vị . Tìm giá trị của x, biết NTK của Fe=56.
2. X, Y, R, A, B, M theo thứ tự là 6 nguyên tố liên tiếp trong bảng tuần hoàn có tổng số đơn vị điện tích hạt nhân là 63 (X có số đơn vị điện tích hạt nhân nhỏ nhất).
a. Xác định số đơn vị điện tích hạt nhân của X, Y, R, A, B, M.
b. Viết cấu hình electron của X2−, Y−, R, A+, B2+, M3+. So sánh bán kính của chúng và giải thích?
Câu 4 (2,0 điểm): Hợp chất X được sử dụng làm thuốc pháo, ngòi nổ, thuốc đầu diêm, thuốc giúp nhãn ra hoa,… X có khối lượng mol bằng 122,5 g/mol, chứa 3 nguyên tố, trong đó nguyên tố thứ nhất có 7 electron s, nguyên tố thứ hai có 11 electron p và nguyên tố thứ ba có 4 electron p. Thành phần phần trăm khối lượng nguyên tố có 4 electron p trong X bằng 39,19%.
a. Xác định công thức phân tử của X.
b. Viết công thức cấu tạo Lewis, chỉ rõ loại liên kết có trong X.
Câu 5 (2,0 điểm): Hydrogen sulfide (H2S) là một chất khí không màu, mùi trứng thối, độc. Theo tài liệu của Cơ quan Quản lí an toàn và sức khỏe Hoa Kì, nồng độ H2S khoảng 100 ppm gây kích thích màng phổi. Nồng độ khoảng 400 – 700 ppm, H2S gây nguy hiểm đến tính mạng chỉ trong 30 phút. Nồng độ trên 800 ppm gây mất ý thức và nuy cơ làm tử vong ngay lập tức.
a. Viết công thức Lewis và công thức cấu tạo của H2S.
b. Em hiểu thể nào về nồng độ ppm của H2S trong không khí?
c. Một gian phòng trống (250C; 1 bar) có kích thước 3m x 4m x 6m bị nhiễm 10 gam khí H2S. Tính nồng độ của H2S trong gian phòng trên. Đánh giá mức độ độc hại của H2S trong trường hợp này.
Câu 6 (2,0 điểm): Hòa tan hết 2,3 gam hỗn hợp có chứa kim loại barium và hai kim loại kiềm kế tiếp nhau trong nhóm IA của bảng tuần hoàn vào nước, thu được dung dịch X và 619,75 mL khí (250C và 1 bar). Nếu thêm 1,278 gam Na2SO4 vào dung dịch X và khuấy đều thì sau khi phản ứng kết thúc, nước lọc vẫn còn ion Ba2+. Nếu thêm 1,491 gam Na2SO4 vào dung dịch X và khuấy đều thì sau khi phản ứng kết thúc, nước lọc có mặt ion .
a. Viết các phương trình phản ứng xảy ra.
b. Dựa vào bảng tuần hoàn, hãy xác định tên hai kim loại kiềm ở trên.
Câu 7 (3,0 điểm):
1. Dưới tác dụng của chất xúc tác, glucose tạo thành các sản phẩm khác nhau:
– Lên men tạo thành ethanol:
(1)
– Ethanol lên men tạo thành acetic acid:
(2)
a. Cho biết vai trò của các chất trong các phản ứng (1) và (2).
b. Tính lượng glucose cần dùng để thu được 1 lít acetic acid 1M. Giả sử hiệu suất của cả quá trình là 50%.
2. Nitric acid (HNO3) là hợp chất vô cơ, trong tự nhiên HNO3 được hình thành trong những cơn mưa giông kèm sấm chớp. Nitric acid là một acid độc, ăn mòn và dễ gây cháy, là một trong những tác nhân gây mưa acid. Thực hiện thí nghiệm xác định công thức của một oxide của kim loại iron bằng nitric acid đặc, nóng, thu được 2,479 lít (đkc) khí màu nâu là nitrogen dioxide. Phần dung dịch đem cô cạn thì được 72,6 gam Fe(NO3)3. Giả sử phản ứng không tạo thành các sản phẩm khác.
a. Lập phương trình hóa học của phản ứng xảy ra bằng phương pháp thăng bằng electron.
b. Xác định công thức của iron oxide.
3. Có nhiều vụ tai nạn giao thông xảy ra do người lái xe uống rượu. Theo luật định, hàm lượng ethanol trong máu người lái xe không vượt quá 0,02% theo khối lượng. Để xác định hàm lượng ethanol trong máu của người lái xe cần chuẩn độ bằng K2Cr2O7 trong môi trường acid. Khi đó Cr+6 bị khử thành Cr+3, ethanol (C2H5OH) bị oxi hóa thành acetaldehyde (CH3CHO).
Câu 8 (4,0 điểm):
1. Ion XYn3- có tổng số hạt nơtron, proton, electron là 145, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 49. Số hạt mang điện trong nguyên tử X nhiều hơn số hạt mang điện trong nguyên tử Y là 14. Trong ion Y2- có tổng số hạt là 26, trong đó số hạt mang điện dương bằng số hạt không mang điện. Xác định XYn3-.
2. Hãy cho biết công thức cấu tạo, trạng thái lai hóa của nguyên tử trung tâm và dạng hình học phân tử của: H2O; SO3; CH4; CO2. Biết H (Z=1); O (Z=8); S (Z=16); C (Z=6).
3. Nguyên tố Y là phi kim, oxit cao nhất của Y là A, hợp chất khí của Y với hiđro là B. Tỉ khối hơi của B so với A là . Tìm Y, A, B.
| SỞ GIÁO DỤC VÀ ĐÀO TẠO HÀ NAM TRƯỜNG THPT A KIM BẢNG (Đáp án – HDC chấm có 07 trang) | ĐÁP ÁN VÀ HƯỚNG DẪN CHẤM ĐỀ THI ĐỀ XUẤT KỲ THI CHỌN HSG CẤP TỈNH NĂM HỌC 2022 – 2023 Môn thi: Hóa học 10 |
Câu 1 (2 điểm): Cho 3 hydrocarbon X, Y, Z đều có 2 nguyên tử C trong phân tử. Số nguyên tử H trong các phân tử tăng dần theo thứ tự X, Y, Z.
a. Viết công thức cấu tạo của X, Y, Z.
b. Viết phương trình đốt cháy hoàn toàn X, Y, Z với hệ số nguyên tối giản.
c. Tính biến thiên enthalpy của mỗi phản ứng dựa vào enthalpy tạo thành chuẩn trong bảng sau:
| Chất | X(g) | Y(g) | Z(g) | CO2(g) | H2O(g) |
| +227,0 | +52,47 | –84,67 | –393,5 | –241,82 |
d. Từ kết quả tính toán đưa ra kết luận về ứng dụng của phản ứng đốt cháy X, Y, Z trong thực tiễn.
| Câu 1 | NỘI DUNG | Điểm |
| a | X: C2H2 (CH≡CH); Y: C2H4 (CH2=CH2); Z: C2H6 (CH3 – CH3) | 0,5 |
| b | 2C2H2(g) + 5O2(g) 4CO2(g) + 2H2O(g) C2H4(g) + 3O2(g) 2CO2(g) + 2H2O(g) 2C2H6(g) + 7O2(g) 4CO2(g) + 6H2O(g) | 0,5 |
| c | 0,25 0,25 0,25 | |
| d | Kết quả tính toán của phản ứng đốt cháy C2H2; C2H4 và C2H6 giá trị lớn và < 0 (giải phóng năng lượng lớn) nên trong thực tiễn được sử dụng làm nhiên lệu. Riêng C2H2 trong thực tiễn làm đèn xì acetylene vì đèn xì acetylene có nhiệt độ cao nhất. | 0,25 |
Câu 2 (2,5 điểm):
1. Đường sucrose (C12H22O11) là một đường đôi. Trong môi trường acid ở dạ dày và nhiệt độ cơ thể, sucrose bị thủy phân thành đường glucose và fructose, sau đó bị oxy hóa bởi oxygen tạo thành CO2 và H2O. Sơ đồ thay đổi năng lượng hóa học của phản ứng được cho như hình dưới đây:
a. Dựa theo đồ thị, hãy cho biết phản ứng trong đó là tỏa nhiệt hay thu nhiệt. Vì sao?
b. Viết PTHH của phản ứng thủy phân đường sucrose. Phản ứng trong sơ đồ có phải là phản ứng oxi hóa – khử hay không?
c. Khi 1 mol đường sucrose bị đốt cháy hoàn toàn với một lượng vừa đủ oxygen ở điều kiện chuẩn tỏa ra một lượng nhiệt là 5645 kJ. Xác định biến thiên enthalpy chuẩn của phản ứng oxi hóa sucrose.
d. Nếu 5,00 gam đường sucrose được đốt cháy hoàn toàn ở cùng điều kiện như trên thì biến thiên enthalpy quá trình bằng bao nhiêu?
2. 14C là một đồng vị phóng xạ β của cacbon có chu kì bán hủy t1/2 = 5700 năm. Hàm lượng 14C trong khí quyển và trong cơ thể sinh vật sống luôn ổn định. Khi các sinh vật chết, tỉ lệ giảm dần. Mỗi gam cacbon tổng cộng trong cơ thể sống có độ phóng xạ của 14C bằng 0,277 Bq (phân rã/giây).
a. Nguyên tử 14C biến đổi ra sao sau khi phân rã?
b. Một mẫu vật có nguồn gốc sinh học có tỉ lệ bằng 0,25 lần tỉ lệ trong cơ thể sống. Tính tuổi mẫu vật.
| Câu 2 | NỘI DUNG | Điểm |
| 1 | a. Phản ứng tỏa nhiệt, do nhiệt tạo thành chất phản ứng lớn hơn nhiệt tạo thành sản phẩm. | 0,5 |
| b. C12H22O11 + H2O C6H12O6(fructose) + C6H12O6(glucose); đây không phải là phản ứng oxi hóa – khử do không có sự thay đổi số oxi hóa. | 0,25 0,25 | |
| c. C12H22O11(s) + 12O2(g) 12CO2(g) + 11H2O(l) = –5645 kJ | 0,25 | |
| 0,25 | ||
| 2 | a. 14C → 14N + β– Þ 14C trở thành nguyên tử 14N b. Gọi N0 là tỉ lệ trong hệ đang sống và N là tỉ lệ tương tự của mẫu đã lấy từ hệ đã chết t năm trước đây. Ta có: N = N0. E-kt trong đó k = ln2/t1/2 Þ t = (năm) | 0,5 0,5 |
Câu 3: (2,5 điểm)
1. Chlorine (Z=17) thường được sử dụng để khử trùng nước máy trong sinh hoạt. Trong tự nhiên nguyên tố Chlorine có hai đồng vị là và với nguyên tử khối trung bình là 35,48. Trong một hợp chất FeClx có chứa 41,78% khối lượng đồng vị . Tìm giá trị của x, biết NTK của Fe=56.
2. X, Y, R, A, B, M theo thứ tự là 6 nguyên tố liên tiếp trong bảng tuần hoàn có tổng số đơn vị điện tích hạt nhân là 63 (X có số đơn vị điện tích hạt nhân nhỏ nhất).
a. Xác định số đơn vị điện tích hạt nhân của X, Y, R, A, B, M.
b. Viết cấu hình electron của X2−, Y−, R, A+, B2+, M3+. So sánh bán kính của chúng và giải thích?
| Câu 3 | NỘI DUNG | Điểm |
| 1 | Gọi x là phần trăm số nguyên tử của đồng vị và (100-x) là phần trăm số nguyên tử của đồng vị Ta có: → x = 24,23 Vậy phần trăm số nguyên tử của đồng vị là 24,23%, đồng vị là 75,77%. %m (FeClx)= => x = 2. | 0,5 0,5 |
| 2 | Gọi Z là số điện tích hạt nhân của X => Số điện tích hạt nhân của Y, R, A, B, M lần lượt (Z + 1), (Z + 2), (Z + 3), (Z + 4), (Z+5) Theo giả thiết Z + (Z + 1) + (Z + 2) + (Z + 3) + (Z + 4)+ (Z + 5) = 63 => Z = 8 ® 8X; 9Y; 10R; 11A; 12B, 13M (O) (F) (Ne) (Na) (Mg) (Al) O2-, F–, Ne, Na+, Mg2+, Al3+ đều có cấu hình e: 1s2 2s2 2p6 Số lớp e giống nhau => bán kính r phụ thuộc điện tích hạt nhân. Điện tích hạt nhân càng lớn thì bán kính r càng nhỏ. rO2- > rF-> rNe >rNa+ > rMg2+ > rAl3+ | 0,5 0,5 0,5 |
Câu 4 (2,0 điểm): Hợp chất X được sử dụng làm thuốc pháo, ngòi nổ, thuốc đầu diêm, thuốc giúp nhãn ra hoa,… X có khối lượng mol bằng 122,5 g/mol, chứa 3 nguyên tố, trong đó nguyên tố thứ nhất có 7 electron s, nguyên tố thứ hai có 11 electron p và nguyên tố thứ ba có 4 electron p. Thành phần phần trăm khối lượng nguyên tố có 4 electron p trong X bằng 39,19%.
a. Xác định công thức phân tử của X.
b. Viết công thức cấu tạo Lewis, chỉ rõ loại liên kết có trong X.
| Câu 4 | NỘI DUNG | Điểm |
| a | – Nguyên tố thứ nhất có 7 electron s: 1s22s22p63s23p64s1 (K); – Nguyên tố thứ hai có 11 electron p: 1s22s22p63s23p5 (Cl); – Nguyên tố thứ ba có 4 electron p: 1s22s22p4 (O). | 0,5 0,5 |
| b | Cấu tạo X: Gồm liên kết K+ và là liên kết ion; liên kết Cl–O và Cl=O là các liên kết cộng hóa trị phân cực. | 0,5 0,5 |
Câu 5 (2,0 điểm): Hydrogen sulfide (H2S) là một chất khí không màu, mùi trứng thối, độc. Theo tài liệu của Cơ quan Quản lí an toàn và sức khỏe Hoa Kì, nồng độ H2S khoảng 100 ppm gây kích thích màng phổi. Nồng độ khoảng 400 – 700 ppm, H2S gây nguy hiểm đến tính mạng chỉ trong 30 phút. Nồng độ trên 800 ppm gây mất ý thức và nuy cơ làm tử vong ngay lập tức.
a. Viết công thức Lewis và công thức cấu tạo của H2S.
b. Em hiểu thể nào về nồng độ ppm của H2S trong không khí?
c. Một gian phòng trống (250C; 1 bar) có kích thước 3m x 4m x 6m bị nhiễm 10 gam khí H2S. Tính nồng độ của H2S trong gian phòng trên. Đánh giá mức độ độc hại của H2S trong trường hợp này.
| Câu 5 | NỘI DUNG | Điểm |
| a | 0,5 | |
| b | Nồng độ ppm của H2S trong không khí là số lít khí H2S có trong 1.106 lít không khí. | 0,5 |
| c | Thể tích khí H2S có trong 1.106 L là: Vậy, nồng độ của H2S trong gian phòng là là 101,38 ppm nên gây kích thích màng phổi. | 0,25 0,25 0,25 0,25 |
Câu 6 (2,0 điểm): Hòa tan hết 2,3 gam hỗn hợp có chứa kim loại barium và hai kim loại kiềm kế tiếp nhau trong nhóm IA của bảng tuần hoàn vào nước, thu được dung dịch X và 619,75 mL khí (250C và 1 bar). Nếu thêm 1,278 gam Na2SO4 vào dung dịch X và khuấy đều thì sau khi phản ứng kết thúc, nước lọc vẫn còn ion Ba2+. Nếu thêm 1,491 gam Na2SO4 vào dung dịch X và khuấy đều thì sau khi phản ứng kết thúc, nước lọc có mặt ion .
a. Viết các phương trình phản ứng xảy ra.
b. Dựa vào bảng tuần hoàn, hãy xác định tên hai kim loại kiềm ở trên.
| Câu 6 | NỘI DUNG | Điểm |
| a | 0,5 | |
| Khi thêm 0,009 mol Na2SO4, Ba2+ dư – Khi thêm 0,0105 mol Na2SO4, (1) (2) Thay (2) vào (1): Hai kim loại thỏa mãn: Na (M = 23) và K (M = 39) | 0,25 0,25 0,5 0,5 |
Câu 7 (3,0 điểm):
1. Dưới tác dụng của chất xúc tác, glucose tạo thành các sản phẩm khác nhau:
– Lên men tạo thành ethanol:
(1)
– Ethanol lên men tạo thành acetic acid:
(2)
a. Cho biết vai trò của các chất trong các phản ứng (1) và (2).
b. Tính lượng glucose cần dùng để thu được 1 lít acetic acid 1M. Giả sử hiệu suất của cả quá trình là 50%.
2. Nitric acid (HNO3) là hợp chất vô cơ, trong tự nhiên HNO3 được hình thành trong những cơn mưa giông kèm sấm chớp. Nitric acid là một acid độc, ăn mòn và dễ gây cháy, là một trong những tác nhân gây mưa acid. Thực hiện thí nghiệm xác định công thức của một oxide của kim loại iron bằng nitric acid đặc, nóng, thu được 2,479 lít (đkc) khí màu nâu là nitrogen dioxide. Phần dung dịch đem cô cạn thì được 72,6 gam Fe(NO3)3. Giả sử phản ứng không tạo thành các sản phẩm khác.
a. Lập phương trình hóa học của phản ứng xảy ra bằng phương pháp thăng bằng electron.
b. Xác định công thức của iron oxide.
3. Có nhiều vụ tai nạn giao thông xảy ra do người lái xe uống rượu. Theo luật định, hàm lượng ethanol trong máu người lái xe không vượt quá 0,02% theo khối lượng. Để xác định hàm lượng ethanol trong máu của người lái xe cần chuẩn độ bằng K2Cr2O7 trong môi trường acid. Khi đó Cr+6 bị khử thành Cr+3, ethanol (C2H5OH) bị oxi hóa thành acetaldehyde (CH3CHO).
a) Lập phương trình hóa học của phản ứng xảy ra bằng phương pháp thăng bằng electron.
b) Khi chuẩn độ 25 gam huyết tương máu của một lái xe cần dùng 20 ml dung dịch K2Cr2O7 0,01M. Người lái xe đó có vi phạm luật hay không? Tại sao? Giả sử rằng trong thí nghiệm trên chỉ có ethanol tác dụng với K2Cr2O7.
| Câu 7 | NỘI DUNG | Điểm |
| 1 | (1) (2) b) | 0,25 0,25 0,25 0,25 |
| 2 | FexOy + (6x – 2y)HNO3 xFe(NO3)3 + (3x – 2y)NO2 + (3x – y)H2O | 0,5 0,5 |
| 3 | a) . Vậy người lái xe vi phạm luật giao thông. | 0,5 0,5 |
Câu 8 (4,0 điểm):
1. Ion XYn3- có tổng số hạt nơtron, proton, electron là 145, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 49. Số hạt mang điện trong nguyên tử X nhiều hơn số hạt mang điện trong nguyên tử Y là 14. Trong ion Y2- có tổng số hạt là 26, trong đó số hạt mang điện dương bằng số hạt không mang điện. Xác định XYn3-.
2. Hãy cho biết công thức cấu tạo, trạng thái lai hóa của nguyên tử trung tâm và dạng hình học phân tử của: H2O; SO3; CH4; CO2. Biết H (Z=1); O (Z=8); S (Z=16); C (Z=6).
3. Nguyên tố Y là phi kim, oxit cao nhất của Y là A, hợp chất khí của Y với hiđro là B. Tỉ khối hơi của B so với A là . Tìm Y, A, B.
| Câu 8 | NỘI DUNG | Điểm |
| 1 | Gọi số hạt trong nguyên tử của các nguyên tố như sau: Proton, electron nơtron X Z1 N1 Y Z2 N2 Theo đề bài ta có các phương trình sau: (2Z1 + N1) + (2Z2 + N2)n + 3 = 145 (1) (2Z1 + 2nZ2) – (N1 + nN2) + 3 = 49 (2) 2Z1 – 2Z2 = 14 (3) 2Z2 + N2 + 2 = 26 (4) Z2 = N2 (5) Từ (3), (4), (5) → Z2 = N2 = 8, Z1 = 15 (6) Vậy X là nguyên tố Photpho, Y là nguyên tố Oxi Từ (1), (2) → 2Z1 + 2nZ2 = 94 (7) và N1 + nN2 = 48 (8) Từ (6), (7), (8) → n = 4 và N1 = 16 Vậy ion cần tìm là Ion PO43- | 0,25 0,25 0,25 0,25 0,25 0, 5 0,25 |
| 2 | CTPT CTCT Trạng thái lai hóa Dạng hình học H2O H-O-H sp3 Hình chữ V SO3 O O=S O sp2 Tam giác đều CH4 sp3 Tứ diện đều CO2 O=C=O sp Đường thẳng | 0,25 0,25 0,25 0,25 |
| 3 | VìY là phi kim nên Y thuộc các nhóm IVA, VA, VIA, VIIA. Giả sử Y thuộc nhóm nA Trường hợp 1: n là lẻ Công thức oxit cao nhất là Y2On (A); hợp chất khí với Hidro là YH8-n (B). Vì tỉ khối hơi của B so với A là nên có pt Với n=5 → MY = 95,67 (loại). Với n=7 → MY = 145,67 (loại). Trường hợp 2: n là chẵn Công thức oxit cao nhất là YOn/2 (A); hợp chất khí với Hidro là YH8-n (B) Vì tỉ khối hơi của B so với A là nên có pt Với n=4 → MY = 12 Cacbon. Với n=6 → MY = 24,28 (loại). Vậy Y là C; A là CO2; B là CH4 | 0, 5 0,5 |
O2 Education gửi các thầy cô link download đề thi
Các thầy cô có thể xem thêm nhiều đề thi hsg của các tỉnh khác tại
Tổng hợp đề thi hsg lớp 10 môn hoá học
Đề thi hsg môn hóa lớp 10 olympic Đắk Lắk năm 2023 2024
| SỞ GIÁO DỤC VÀ ĐÀO TẠO ĐẮK LẮK ĐỀ THI CHÍNH THỨC (Đề thi gồm có 03 trang) | KỲ THI OLYMPIC TRUYỀN THỐNG 10/3 LẦN THỨ VII – NĂM 2024 Môn thi: Hóa Học – Khối: 10 Ngày thi: 02/03/2024Thời gian làm bài: 180 phút (Không tính thời gian phát đề) |
| Thí sinh làm mỗi câu trên một tờ giấy thi riêng và ghi rõ câu số … ở trang đầu tiên của tờ giấy thi. |
Câu 1.(4,0 điểm)
1.1.
a. Hàm lượng các đồng vị bền của một nguyên tố hóa học thường được xác định bằng phương pháp phổ khối lượng. Trong phương pháp này, các nguyên tử thường được ion hóa thành cation mang một điện tích dương. Hình bên là phổ khối lượng của nguyên tố Boron (B). Xác định nguyên tử khối trung bình của B.
b. Cho biết số lượng và cường độ tương đối của các tín hiệu trên phổ khối lượng của cation B2+.
1.2. Tổng số hạt trong hai nguyên tử X và Y là 42 hạt. Trong đó tổng hạt của nguyên tử Y lớn hơn tổng hạt của nguyên tử X là 6. Trong nguyên tử X số hạt mang điện tích gấp đôi hạt không mang điện tích. Số hạt mang điện tích dương trong nguyên tử X ít hơn số hạt mang điện tích dương trong Y là 2 hạt.
a. Xác định tên hai nguyên tố X, Y.
b. Xác định bộ 4 số lượng tử của electron cuối cùng của 2 nguyên tử X, Y (Qui ước: mL = +l, …, 0, …, -l và electron đầu tiên của một obitan có ms = +).
c. Viết công thức VSEPR của các phân tử XY; XY2 và ion (XY3)2-. Cho biết trạng thái lai hóa và dạng hình học của nguyên tử trung tâm trong các phân tử và ion trên?
1.3. Một mẫu đá được tìm thấy với thành phần 13,2 mg 238U và 2,06 mg 206Pb. Biết trong quá trình phân huỷ 238U thành 206Pb có chu kì phân rã là 4,51.109 năm. Tính tuổi của mẫu đá đó ?
Câu 2.(4,0 điểm)
2.1. Công đoạn đầu tiên của quá trình sản xuất silicon có độ tinh khiết cao phục vụ cho công nghệ bán dẫn được thực hiện bằng phản ứng sau :
SiO2(s) + 2C(s) Si(s) + 2CO(g) (1).
a. Tính ,
,
của quá trình điều chế silicon theo phản ứng (1).
b. Phản ứng (1) sẽ diễn ra ưu thế theo chiều thuận bắt đầu từ nhiệt độ nào? (Coi sự phụ thuộc của và
vào nhiệt độ là không đáng kể). Biết ở điều kiện chuẩn, tại 298 K, entropy và enthalpy của các chất:
| Chất | SiO2(s) | C(s) | Si(s) | CO(g) |
| 41,8 | 5,7 | 18,8 | 197,6 | |
| – 910,9 | 0,0 | 0,0 | – 110,5 |
2.2. Haber là một trong số các nhà hóa học có đóng góp quan trọng vào phản ứng tổng hợp NH3 từ khí H2 và N2.
– Trong thí nghiệm 1 tại 4720C, Haber và cộng sự thu được [H2] = 0,12070M; [N2] = 0,04020M; [NH3] = 0,00272M khi hệ đạt đến cân bằng.
– Trong thí nghiệm 2 tại 5000C, thu được hỗn hợp cân bằng có áp suất riêng phần của H2 là 0,733 atm, N2 là 0,527 atm và của NH3 là 1,73.10-3 atm.
Trong phản ứng sau: N2(g) + 3H2 (g) 2NH3 (g)
Phản ứng thuận tỏa nhiệt hay thu nhiệt? Tại sao?
2.3. Giả thiết ion được tạo thành từ nguyên tử F và ion F–.
a. Thuyết liên kết cộng hóa trị (thuyết VB) có thể giải thích được sự hình thành ion theo con đường nêu trên hay không ? Giải thích.
b. Vẽ giản đồ năng lượng MO và viết cấu hình electron cho ion . Theo thuyết MO, ion này có tồn tại hay không? Giải thích.
Câu 3.(4,0 điểm)
3.1. Hòa tan 0,535 gam NH4Cl vào 100 ml dung dịch NH3 0,01M thu được dung dịch X. Tính pH của dung dịch X. Cho biết NH3 có .
3.2. Tìm khoảng pH tối ưu để tách một trong hai ion Ba2+ và Sr2+ ra khỏi dung dịch chứa BaCl2 0,1M và SrCl2 0,1M với thuốc thử K2Cr2O7 1M. Biết rằng trong dung dịch K2Cr2O7 có các cân bằng:
Cr2O72- + H2O 2HCrO4– K1 = 2,3.10-2
HCrO4– H+ + CrO42- K2 = 3,4.10-7
Cho tích số tan của BaCrO4 là 10-9,7 và của SrCrO4 là 10-4,4. Điều kiện để xem một ion kết tủa hoàn toàn là nồng độ của ion đó không vượt quá 10-6M.
3.3. Phân tử CuCl kết tinh dưới dạng lập phương tâm diện.
(như hình bên)
a. Tính số ion Cu+ và Cl – rồi suy ra số phân tử CuCl chứa trong ô mạng cơ sở.
b. Xác định bán kính ion của Cu+. Biết khối lượng riêng của CuCl là 4,136 g/cm3; bán kính ion Cl– là 1,84 Ao; MCu = 63,5 gam/mol; MCl = 35,5 gam/mol; NA = 6,02.1023.
3.4. Năng lượng mạng lưới của một tinh thể có thể hiểu là năng lượng cần thiết để tách những hạt ở trong tinh thể đó ra cách xa nhau những khoảng vô cực.
Hãy thiết lập chu trình để tính năng lượng mạng lưới tinh thể CaCl2 biết:
– Sinh nhiệt của CaCl2: DH1 = -795 kJ/mol
– Nhiệt nguyên tử hoá của Ca: DH2 = 192 kJ/mol
– Năng lượng ion hoá (I1 + I2) của Ca = 1745 kJ/mol
– Năng lượng phân ly liên kết Cl2: DH3 = 243 kJ/mol
– Ái lực với electron của Cl: A = -364 kJ/mol
Câu 4.(4,0 điểm)
4.1. Cho biết phản ứng: K2S2O3 + H2SO4 loãng K2SO4 + SO2 + S + H2O.
Có phải là phản ứng oxi hóa – khử hay không? Giải thích.
4.2.
a. Cân bằng phản ứng oxi hoá – khử sau theo phương pháp thăng bằng electron:
FeCl2 + KMnO4 + H2SO4 ® Fe2(SO4)3 + Cl2 + K2SO4 + MnSO4 + H2O
b. Cân bằng phản ứng oxi hoá – khử sau theo phương pháp thăng bằng ion- electron:
4.3. Trong không khí dung dịch K2S bị oxi hoá một phần để giải phóng ra lưu huỳnh. Viết phương trình phản ứng và tính hằng số cân bằng.
Cho: E0(O2/H2O) = 1,23 V; E0(S/S2-) = – 0,48 V; 2,3RT/F ln = 0,0592lg
4.4. Tính nồng độ ban đầu của biết rằng khi đo sức điện động của pin
Pt │I– (0,1M); I3– (0,02M) ║MnO4– (0,05M); Mn2+ (0,01M); (CM) │Pt ở 25oC có giá trị là 0,824 V. Cho biết
.
Câu 5.(4,0 điểm)
5.1. Bố trí thí nghiệm như hình sau:
Nêu hiện tượng và viết các phản ứng xảy ra khi thí nghiệm được tiến hành.
5.2. So sánh nhiệt độ nóng chảy của: MgO, KCl, NaCl, FeCl3.
5.3. X là muối có công thức NaIOx. Hoà tan X vào nước thu được dung dịch A. Cho khí SO2 đi từ từ qua dung dịch A, thấy dung dịch xuất hiện màu nâu, tiếp tục sục SO2 vào thì mất màu nâu và thu được dung dịch B. Thêm một ít dung dịch HNO3 vào dung dịch B và sau đó thêm lượng dư dung dịch AgNO3, thấy xuất hiện kết tủa màu vàng. Thêm dung dịch H2SO4 loãng và KI vào dung dịch A, thấy xuất hiện dung dịch màu nâu và màu nâu mất đi khi thêm dung dịch Na2S2O3 vào.
a. Viết các phương trình phản ứng xảy ra dưới dạng ion thu gọn.
b. Để xác định chính xác công thức của muối X người ta hoà tan 0,100 gam X vào nước, thêm lượng dư KI và vài mililít dung dịch H2SO4 loãng, dung dịch có màu nâu. Chuẩn độ I2 sinh ra bằng dung dịch Na2S2O3 0,1M với chất chỉ thị màu là hồ tinh bột cho tới khi mất màu, thấy tốn hết 37,4 mL dd Na2S2O3. Tìm công thức X.
—————— HẾT ——————
– Thí sinh không được sử dụng tài liệu và bảng tuần hoàn các nguyên tố hóa học.
– Cán bộ coi thi không giải thích gì thêm.
Họ, tên thí sinh: …………………………………………….; Số báo danh: ………………………………………………
Chữ ký của Cán bộ coi thi 1: ………………………….; Chữ ký của Cán bộ coi thi 2: …………………………
O2 Education gửi các thầy cô link download đề thi
Các thầy cô có thể xem thêm nhiều đề thi hsg của các tỉnh khác tại
Tổng hợp đề thi hsg lớp 10 môn hoá học
Đề thi hsg môn hóa lớp 10 THPT Chúc Động Hà Nội năm 2023 2024
| TRƯỜNG THPT CHÚC ĐỘNG HĐ THI OLYMPIC LỚP 10, 11 Kỳ thi ngày 27/2/2024 | ĐỀ THI OLYMPIC NĂM HỌC 2023-2024 Môn thi: Hóa học Lớp: 10 Thời gian làm bài: 120 phút (Đề thi gồm có 04 câu, 03 trang) |
Họ và tên thí sinh: ……………………………………………….. SBD: …………………
Câu 1(4 điểm)
Câu 2(5,5 điểm)
a. Viết cấu hình electron và xác định vị trí của chlorine trong bảng tuần hoàn các nguyên tố hóa học.
b. Cho biết tính chất hóa học cơ bản của chlorine (kim loại hay phi kim). Viết phương trình hóa học xảy ra (nếu có) khi cho chlorine tác dụng với các chất: hydrogen, iron.
c. Viết công thức oxide cao nhất và hydroxide tương ứng, cho biết chúng có tính acid hay base?
Câu 3(4 điểm)
Câu 4(6,5 điểm)
| Chất | N2O4 (g) | CO (g) | N2O (g) | CO2 (g) |
| 9,16 | -110,50 | 82,05 | -393,50 |
N2O4 (g) + 3CO (g) N2O (g) + 3CO2 (g)
Từ số liệu năng lượng liên kết ở bảng:
| Liên kết | C – H | C – C | O = O | C = O | O – H |
| Năng lượng (kJ/mol) | 418 | 346 | 494 | 732 | 459 |
Hãy tính biến thiên enthalpy của phản ứng đốt cháy 2 mol butane theo năng lượng liên kết.
———–HẾT———-
K=39, O=16, Si=28, Na=23, Mg=24, Al=27, N=14
1H, 6C, 8O, 11Na, 16S, 19K
O2 Education gửi các thầy cô link download đề thi
Các thầy cô có thể xem thêm nhiều đề thi hsg của các tỉnh khác tại
Tổng hợp đề thi hsg lớp 10 môn hoá học
Đề thi hsg môn hóa lớp 10 cụm trường Yên Dũng Bắc Giang năm 2023 2024
| SỞ GD&ĐT BẮC GIANG CỤM HUYỆN YÊN DŨNG ——————– ĐỀ THI CHÍNH THỨC (Đề thi có ___ trang) | ĐỀ THI CHỌN HSG VĂN HÓA CỤM HUYỆN YÊN DŨNG NĂM HỌC 2023 – 2024 MÔN: HOÁ HỌC 10 Thời gian làm bài: 120 phút (không kể thời gian phát đề) |
| Họ và tên: …………………………………………………………………. | Số báo danh: ……. | Mã đề 301 |
Cho biết nguyên tử khối: H=1; C=12; N=14; O=16; Cl=35,5; Na=23; K=39; Mg=24; Ba=137; P=31; S=32; Ca=40; Fe=56; Cu=64; Br=80, Mn=55 ; F=19; I=127; Al=27
Thể tích khí ở đkc (25oC, 1 bar) được tính theo công thức: V = n ´ 24,79
A-PHẦN TRẮC NGHIỆM ( 14,0 ĐIỂM)
Câu 1. Nguyên tử nguyên tố X có cấu hình electron lớp ngoài cùng là 4s1. Nguyên tố Y thuộc chu kỳ 3, nhóm VIA. Phát biểu đúng về X và Y là
A. Độ âm điện của X > Y B. Tính phi kim của X > Y
C. Bán kính nguyên tử của X > Y D. Tính kim loại của X < Y
Câu 2. Cho các phát biểu sau
(a) Ở trạng thái cơ bản cấu hình electron nguyên tử của nguyên tố X là 1s22s22p63s23p4. Vị trí của nguyên tố X trong bảng tuần hoàn là ô số 16, chu kỳ 3, nhóm VIB.
(b) Nguyên tử của nguyên tố X có 10p, 10e và 10n. Trong bảng tuần hoàn X ở chu kỳ 2, nhóm VA.
(c) Ion X2- có cấu hình electron lớp ngoài cùng là 2s22p6. Nguyên tố X thuộc ô 12, chu kỳ 3, nhóm IIA.
(d) Các khối nguyên tố d và f đều là kim loại.
Số phát biểu sai là
A. 2 B. 4 C. 1 D. 3
Câu 3. Cho sơ đồ phản ứng: FeO + HNO3 → Fe(NO3)3 + NxOy + H2O
(biết x, y là các số nguyên). Sau khi cân bằng với hệ số nguyên tối giản, tổng hệ số của các chất tham gia phản ứng là
A. 12x − 6y. B. 16x − 4y. C. 21x − 8y. D. 10x − 4y.
Câu 4. Cho phản ứng: 3Cu + 8HNO3 3Cu(NO3)2 + 2NO + 4H2O. Tỉ lệ số phân tử HNO3 đóng vai trò là chất oxi hóa và tổng số phân tử HNO3 tham gia phản ứng là
A. 3:8. B. 2:8. C. 2:10. D. 3:10.
Câu 5. Cho phản ứng hoá học xảy ra ở điều kiện chuẩn sau
2NO2(g) (đỏ nâu) N2O4(g) (không màu)
Biết NO2 và N2O4 có tương ứng là 33,18 kJ/mol và 9,16 kJ/mol. Điều này chứng tỏ phản ứng
A. toả nhiệt, N2O4 bền vững hơn NO2 về năng lượng.
B. thu nhiệt, N2O4 bền vững hơn NO2 năng lượng.
C. toả nhiệt, NO2 bền vững hơn N2O4 năng lượng.
D. thu nhiệt, NO2 bền vững hơn N2O4 năng lượng.
Câu 6. Krypton là một trong những khí hiếm được ứng dụng trong chiếu sáng và nhiếp ảnh. Ánh sáng của krypton có nhiều dải phổ, do đó nó được sử dụng nhiều làm tia laser có mức năng lượng cao. Quan sát biểu thị phổ khối của krypton
Tính thể tích của 1 gam krypton (đkc).
A. 0,448 B. 0,267 C. 0,2955 D. 0,224
Câu 7. Ion Ca2+ cần thiết cho máu của người hoạt động bình thường. Nồng độ ion calcium không bình thường là dấu hiệu của bệnh. Để xác định nồng độ ion calcium, người ta lấy mẫu máu, sau đó kết tủa ion calcium dưới dạng calcium oxalate (CaC2O4) rồi cho calcium oxalate tác dụng với dung dịch potassium permanganate trong môi trường acid theo phản ứng sau:
KMnO4 + CaC2O4 + H2SO4 CaSO4 + K2SO4 + MnSO4 + CO2 + H2O
Giả sử calcium oxalate kết tủa từ 1 mL máu một người tác dụng vừa hết với 2,05 mL dung dịch potassium permanganate (KMnO4) 4,88.10-4M. Nồng độ ion calcium trong máu người đó bằng đơn vị mg Ca2+/100 mL máu là:
A. 8 mg. B. 9 mg. C. 11 mg. D. 10 mg.
Câu 8. Cho sơ đồ chuyển hoá sau (mỗi mũi tên là một phản ứng):
Tổng số phản ứng thuộc loại phản ứng oxi hoá – khử trong dãy chuyển hoá trên là
A. 5. B. 6. C. 4. D. 3.
Câu 9. Dãy chất nào sau đây xếp theo thứ tự nhiệt độ sôi tăng dần?
A. CH4, H2S, H2O. B. H2O, H2S, CH4. C. H2S, CH4, H2O. D. CH4, H2O, H2S.
Câu 10. Hỗn hợp X gồm Al và kim loại M (trong đó số mol M lớn hơn số mol của Al). Hòa tan hoàn toàn 1,08 gam hỗn hợp X bằng 100 ml dung dịch HCl, thu được 0,0525 mol khí H2 và dung dịch Y. Cho dung dịch Y tác dụng với dung dịch AgNO3 dư, thu được 17,9375 gam chất rắn. Biết M có hóa trị II trong muối tạo thành, nhận xét nào sau đây đúng?
A. Nồng độ dung dịch HCl đã dùng là 1,05M.
B. Thành phần phần trăm về khối lượng của kim loại M trong X là 40%.
C. Kim loại M là sắt.
D. Số mol kim loại M là 0,0225 mol.
Câu 11. Cho các phân tử: H2O, NH3, HF, H2S, HCl, CO2. Số phân tử có thể tạo liên kết hydrogen với phân tử cùng loại là
A. 3. B. 6 C. 5. D. 4.
Câu 12. Cho các phát biểu sau về phân tử CO2
(a) Liên kết giữa hai nguyên tử C và O là liên kết cộng hoá trị không phân cực
(b) Liên kết giữa hai nguyên tử C và O là liên kết cộng hoá trị phân cực
(c) Phân tử CO2 có 4 electron hoá trị riêng.
(d) Phân tử CO2 có 4 cặp electron hoá trị riêng.
(e) Trong phân tử CO2 có 3 liên kết σ và 1 liên kết π
(g) Trong phân tử CO2 có 2 liên kết σ và 2 liên kết π
(h) Trong phân tử CO2 có 1 liên kết σ và 3 liên kết π
Số phát biểu không đúng là
A. 4. B. 2. C. 3. D. 5.
Câu 13. Sự xen phủ orbital nào sau đây hình thành liên kết π (pi)?
A. B.
C.
D.
Câu 14. Nguyên tố X có Z = 17. Electron lớp ngoài cùng của nguyên tử nguyên tố X thuộc lớp
A. L. B. M. C. K. D. N.
Câu 15. Bán kính nguyên tử gần đúng của nguyên tử R ở 20000C là 1,965.10-8 cm biết tại nhiệt độ đó khối lượng riêng của R bằng 1,55 g/cm3. Giả thiết trong tinh thể các nguyên tử R có hình cầu, có độ đặc khít là 74%. R là nguyên tố.
A. Ca B. Al C. Cu D. Mg
Câu 16. Nguyên tố X được dùng để chế tạo hợp kim nhẹ, bền, dùng trong nhiều lĩnh vực: hàng không, ô tô, xây dựng, hàng tiêu dùng,… Nguyên tố Y ở dạng , đóng vai trò quan trọng trong các phân tử sinh học như DNA và RNA. Các tế bào sống sử dụng
để vận chuyển năng lượng. Nguyên tử của các nguyên tố X có cấu hình electron kết thúc ở phân lớp 3p1. Nguyên tử của nguyên tố Y có cấu hình electron kết thúc ở phân lớp 3p3. Viết cấu hình electron nguyên tử của X và Y. Tính số electron trong các nguyên tử X và Y. Nguyên tử X, Y lần lượt là
A. kim loại và kim loại. B. kim loại và phi kim.
C. phi kim và kim loại. D. khí hiếm và kim loại.
Câu 17. Hợp kim cobalt (Co) được sử dụng rộng rãi cho các bộ phận động cơ máy bay vì độ bền nhiệt độ cao là một yếu tố quan trọng. Nguyên tử cobalt có cấu hình electron ngoài cùng là 3d74s2. Số hiệu nguyên tử của cobalt là
A. 27. B. 25. C. 29. D. 24.
Câu 18. Dung dịch X là dung dịch HCl. Dung dịch Y là dung dịch NaOH. Cho 60 ml dung dịch X vào cốc chứa 100 gam dung dịch Y, tạo ra dung dịch chỉ chứa một chất tan. Cô cạn dung dịch thu được 14,175 gam chất rắn Z. Nung Z đến khối lượng không đổi, thì chỉ còn lại 8,775 gam chất rắn.
Cho các phát biểu sau:
(1) Công thức của Z là NaCl.2H2O.
(2) Nồng độ phần trăm của Y là 6%.
(3) Nồng độ mol/lít của X là 2,5M
(4) Công thức của Z là NaCl.H2O
(5) Nồng độ mol/lít của X là 2M
Số phát biểu đúng là
A. 2. B. 1. C. 3. D. 4.
Câu 19. Biểu đồ sau biểu diễn nhiệt độ sôi của các hydrogen halide
HF có nhiệt độ sôi cao bất thường so với HCl, HBr, HI là do
A. liên kết H – F phân cực mạnh nhất.
B. fluoride chỉ có số oxi hoá âm trong hợp chất.
C. HF có liên kết hydrogen.
D. fluoride có tính oxi hoá mạnh nhất.
Câu 20. Cho các phương trình nhiệt hóa học sau:
(a) CO(g) + O2(g) → CO2(g)
(b) C2H5OH(l) + O2 → 2CO2(g) + 3H2O(l)
(c) CH4(g) + 2O2(g) → CO2 (g) + 2H2O(l)
Số phản ứng tỏa nhiệt là
Câu 21. Quá trình hình thành phân tử X2 có sự xen phủ orbital như sau:
X2 là chất nào sau đây?
A. Br2. B. O2. C. N2. D. H2.
Câu 22. Tính chất nào sau đây là không đúng khi nói đến nguyên tố X( Z=17)?
A. Hyđroxide tương ứng có tính base
B. Có tính phi kim
C. Công thức oxide cao nhất là X2O7
D. Công thức hợp chất khí với hyđrogen là HX
Câu 23. Xác định biến thiên enthalpy () của phản ứng đốt cháy butane:
C4H10(g) + O2(g) CO2(g) + H2O(g)
Biết năng lượng liên kết trong các hợp chất cho trong bảng sau:
| Liên kết | Phân tử | Eb (kJ/mol) | Liên kết | Phân tử | Eb (kJ/mol) |
| C – C | C4H10 | 346 | C = O | CO2 | 799 |
| C – H | C4H10 | 418 | O – H | H2O | 467 |
| O = O | O2 | 495 |
A. +2356,5 kJ. B. -2626,5 kJ. C. +2626,5 kJ. D. -2356,5 kJ.
Câu 24. Từ carbon graphite có thể điều chế CO2 theo 2 cách
Cách 1: C(s) + O2(g) → CO2(g) ∆H = –393 kJ
Cách 2: C(s)+ O2(g) → CO(g) ∆H1
CO(g) + O2(g) → CO2(g) ∆H2 = –283 kJ
Giá trị của ∆H1 là
A. 110 kJ. B. –110 kJ. C. 55 kJ. D. –676 kJ.
Câu 25. Từ kí hiệu ta có thể suy ra:
A. Lithium có số khối là 3.
B. số hiệu nguyên tử là 7.
C. Hạt nhân nguyên tử Lithium có 3 proton và 7 neutron.
D. Nguyên tử Lithium có 3 electron, hạt nhân có 3 proton và 4 neutron.
Câu 26. Cho X, Y, Z, T là các nguyên tố khác nhau trong số bốn nguyên tố: 11Na, 12Mg, 13Al, 19K và các tính chất được ghi trong bảng sau:
| Nguyên tố | X | Y | Z | T |
| Bán kính nguyên tử (nm) | 0,125 | 0,203 | 0,136 | 0,157 |
Nhận xét nào sau đây đúng:
A. Y là K, T là Na. B. X là Na, Y là K. C. Z là Al, T là Mg. D. X là Na, Z là Al.
Câu 27. Trong phản ứng: K2Cr2O7 + HCl CrCl3 + Cl2 + KCl + H2O
Số phân tử HCl đóng vai trò chất khử bằng k lần tổng số phân tử HCl tham gia phản ứng.Giá trị của k là
A. 3/14. B. 4/7. C. 3/7. D. 1/7.
Câu 28. Nguyên tố Cu có nguyên tử khối trung bình là 63,54 có 2 đồng vị X và Y, biết tổng số khối là 128. Số nguyên tử đồng vị X = 0,37 số nguyên tử đồng vị Y. Vậy số neutron của đồng vị Y ít hơn số neutron của đồng vị X là:
A. 2. B. 4. C. 1 D. 6.
Câu 29. Xét 3 nguyên tố có cấu hình electron lần lượt: X: 1s22s22p63s1; Q: 1s22s22p63s2; Z: 1s22s22p63s23p1. Tính base tăng dần của các hydroxide là
A. Z(OH)3 < XOH< Q(OH)2 B. XOH < Z(OH)3 < Q(OH)2
C. XOH < Q(OH)2< Z(OH)3 D. Z(OH)3 < Q(OH)2 < XOH
Câu 30. Cho các phản ứng sau:
(1) Ca(OH)2 + Cl2 CaOCl2 + H2O
(2) 2NO2 + 2NaOH NaNO3 + NaNO2 + H2O
(3) O3 + 2Ag Ag2O + O2.
(4) 2H2S + SO2 3S + 2H2O
(5) 4KClO3 KCl + 3KClO4.
Số phản ứng oxi hóa – khử là
A. 3. B. 4. C. 5. D. 2.
Câu 31. Cho phản ứng: N2(g) + 3H2(g) 2NH3 (g), ∆H298 = -92,4 kJ.
Chọn phát biểu đúng
A. Nhiệt tạo thành của N2 là 92,4 kJ/mol.
B. Nhiệt phân hủy của NH3 là 46,2 kJ/mol.
C. Nhiệt phân hủy của NH3 là 92,4 kJ/mol.
D. Nhiệt tạo thành của NH3 là 92,4 kJ/mol.
Câu 32. Cho phản ứng: 4HNO3 (đặc) + Cu Cu(NO3)2 + 2NO2 + 2H2O. Trong phản ứng này, HNO3 đóng vai trò
A. là môi trường.
B. là chất khử.
C. là chất oxi hóa.
D. vừa là chất oxi hóa vừa là môi trường.
Câu 33. Y và Z là hai nguyên tố thuộc nhóm IIA và ở 2 chu kỳ liên tiếp nhau trong bảng tuần hoàn. Đây là hai nguyên tố đồng hành song song, có tác dụng bảo vệ xương chắc khỏe, phòng tránh loãng xương, giúp trẻ cao lớn và khỏe mạnh. Nếu thiếu Y thì nguyên tố Z trong cơ thể sẽ phải lấy Y từ các mô mềm để bù lại và gây tình trạng viêm khớp ảnh hưởng lớn đến sức khỏe. Cho m gam hỗn hợp X vào nước dư thấy thoát ra V lít khí H2. Mặt khác, cho m gam hỗn hợp X vào dung dịch HCl dư, sau phản ứng hoàn toàn thấy thoát ra 3V lít khí H2 (thể tích các khí đo ở cùng điều kiện). Phần trăm khối lượng của Y trong hỗn hợp X là:
A. 56,88%. B. 54,54%. C. 37,68%. D. 30,59%.
Câu 34. Hình dưới đây biểu diễn vị trí tương đối của các nguyên tố thuộc chu kỳ nhỏ X, Y, Z và T trong bảng tuần hoàn:
Cho các phát biểu sau, số phát biểu đúng là
(a) Độ âm điện: Y < X < T < Z
(b) Nguyên tố Z thuộc chu kỳ 3, nhóm IA trong bảng tuần hoàn.
(c) Chiều giảm dần bán kính nguyên tử là T > Z > Y > X.
(d) Hợp chất tạo bởi Y và X với hydrogen đều có dạng RH2.
(e) Các ion Y2- và Z3+ có cùng số electron ở lớp vỏ.
A. 1. B. 3. C. 2. D. 4.
Câu 35. Ở trạng thái cơ bản, nguyên tử nguyên tố X có tổng số hạt electron trong phân lớp p là 11. Y là kim loại kiềm thuộc cùng chu kỳ với X. Điều khẳng định nào sau đây là sai?
3.Liên kết hóa học(3)
A. X có bán kính nguyên tử nhỏ nhất so với các kim loại trong cùng chu kì với nó.
B. Trong tự nhiên nguyên tố Y tồn tại cả dạng đơn chất và hợp chất.
C. Công thức phân tử của hợp chất tạo thành giữa X và Y là XY.
D. Hợp chất giữa X và Y là hợp chất ion.
Câu 36. Cho mô hình liên kết trong các hợp chất WX và YXZ2
Phát biểu nào sau đây là đúng?
A. Hợp chất YX2 không phân cực. B. Độ âm điện của X < Y < Z.
C. Số electron hóa trị của X < Y. D. W và Y thuộc cùng một chu kì.
Câu 37. Nguyên tố R là phi kim thuộc chu kì 3, có công thức phân tử hợp chất khí với hydrogen là RH2. Nguyên tố R tạo với kim loại M hợp chất có công thức MR. Đốt cháy hoàn toàn 46,6 gam MR, thu được 4,48 lít khí RO2 (đktc). Có các phát biểu sau:
(a) Hợp chất khí RH2 có mùi đặc trưng.
(b) Khí RO2 tác dụng với dung dịch Ca(OH)2 dư thu được kết tủa.
(c) Kim loại M có nhiệt độ nóng chảy thấp nhất.
(d) Kim loại M tác dụng được với R ở nhiệt độ thường.
(e) Nguyên tố X có số hiệu là 18; độ âm điện của X lớn hơn của R.
Số phát biểu đúng là:
A. 4. B. 5. C. 2. D. 3.
Câu 38. Biến thiên enthalpy của một phản ứng được ghi ở sơ đồ dưới.
Kết luận nào sau đây là đúng?
A. Năng lượng chất tham gia phản ứng nhỏ hơn năng lượng sản phẩm.
C. Biến thiên enthalpy của phản ứng là a kJ/mol.
D. Phản ứng tỏa nhiệt.
Câu 39. Dãy gồm các chất trong phân tử chỉ có liên kết cộng hoá trị phân cực là:
A. H2O, HF, H2S. B. HF, Cl2, H2O. C. O2, H2O, NH3. D. HCl, H2, H2S.
Câu 40. Nhiên liệu rắn dành cho tên lửa tăng tốc của tàu vũ trụ con thoi là một hỗn hợp ammonium perchlorate (amoni peclorat: NH4ClO4) và bột aluminum (nhôm: Al). Khi được đốt đến trên 200oC, NH4ClO4 giải phóng oxygen theo sơ đồ: NH4ClO4 N2 + Cl2 + O2 + H2O
Mỗi một lần phóng tàu con thoi tiêu tốn 94 tấn NH4ClO4. Giả sử tất cả O2 sinh ra tác dụng với bột Al.
(a) Khối lượng Al đã tham gia phản ứng là 36 tấn.
(b) Khối lượng Cl2 và O2 sinh ra lần lượt là 28,4 tấn và 25,6 tấn
(c) Khối lượng Al đã tham gia phản ứng là 28,8 tấn.
(d) Số mol O2 sinh ra là 4. 105 mol
Số phát biểu đúng là
A. 4. B. 3. C. 2. D. 5.
Câu 1 (2 điểm):
1. (1 điểm): Cấu hình e lớp ngoài cùng của nguyên tử X là 4s1.
a) Viết cấu hình electron của nguyên tử X.
b) Xác định vị trí của X trong bảng tuần hoàn, cho biết X là kim loại, phi kim hay khí hiếm?
2. (1 điểm): X, Y, R, A, B, M theo thứ tự là 6 nguyên tố liên tiếp trong Bảng tuần hoàn có tổng số đơn vị điện tích hạt nhân là 63 (X có số đơn vị điện tích hạt nhân nhỏ nhất).
a) Xác định số đơn vị điện tích hạt nhân của X, Y, R, A, B, M.
b) Viết cấu hình electron của X2−, Y−, R, A+, B2+, M3+. So sánh bán kính của chúng và giải thích?
Câu 2 (2 điểm):
1. (1 điểm): Lập phương trình hóa học của các phản ứng sau bằng phương pháp thăng bằng electron, nêu rõ chất oxi hóa, chất khử.
a) Al + HNO3→ Al(NO3)3 + NO++ N2O + H2O. Biết khi cân bằng tỉ lệ số mol giữa N2O và N2 là 2 : 1.
b) Fe3O4 + K2Cr2O7 + KHSO4→ Fe2(SO4)3 + K2SO4 + Cr2(SO4)3 + H2O.
2. (1 điểm): Cho biết phản ứng xảy ra trong thiết bị đo nồng độ cồn bằng khí thở (Breathalyzer) như sau:
C2H5OH + K2Cr2O7 + H2SO4 CH3COOH + Cr2(SO4)3 + K2SO4 + H2O
– Cân bằng phương trình phản ứng trên bằng phương pháp thích hợp.
– Một mẫu khí thở của người điều khiển xe máy tham gia giao thông có thể tích 26,25mL được thổi vào thiết bị Breathalyzer có chứa 1mL K2Cr2O7 0,056 mg/mL (trong môi trường H2SO4 50% và nồng độ ion Ag+ 0.25mg/mL, ổn định). Biết rằng phản ứng xảy ra hoàn toàn. Hãy cho biết người đó có vi phạm luật giao thông hay không và nêu hình thức xử phạt (nếu có).
Sử dụng bảng mức độ phạt đối với người điều khiển xe máy vi phạm nồng độ cồn để trả lời câu hỏi trên.
| Mức độ vi phạm nồng độ cồn | Mức tiền phạt | Hình phạt bổ sung |
| Chưa vượt quá 0,25 mg/1L khí thở. | 2 triệu đồng đến 3 triệu đồng. | Tước giấy phép lái xe từ 10-12 tháng. |
| Vượt quá 0,25 mg- 0,4mg/1L khí thở. | 4 triệu đồng đến 5 triệu đồng. | Tước giấy phép lái xe từ 16-18 tháng. |
| Vượt quá 0,4mg/1L khí thở. | 6 triệu đồng đến 8 triệu đồng. | Tước giấy phép lái xe từ 22-24 tháng. |
(trích từ Nghị định 100/ 2019/ NĐ-CP sửa đổi tại Nghị định 123/2021/NĐ-CP)
Câu 3 (2 điểm):
1. Trộn đều 30,96 gam hỗn hợp bột X gồm MgCO3 và kim loại R có hóa trị không đổi rồi chia làm 2 phần bằng nhau:
– Đốt nóng phần 1 trong không khí, sau khi các phản ứng xảy ra hoàn toàn thu được 15 gam hỗn hợp các oxide kim loại.
– Hòa tan hết phần 2 bằng dung dịch HNO3 loãng, dư, sau phản ứng thu được được dung dịch A và 7,9328 lít hỗn hợp khí B gồm 2 khí, trong đó có khí NO (đkc).
a) Xác định kim loại R và tỉ khối của B so với H2.
b) Nếu hòa tan hoàn toàn lượng X trên vào dung dịch HCl dư, cô cạn dung dịch sau phản ứng thu được bao nhiêu gam chất rắn khan?
2. Đun nóng hỗn hợp X gồm bột Fe và S trong điều kiện không có không khí, thu được hỗn hợp rắn A. Cho A tác dụng với một lượng dư dung dịch HCl thu được sản phẩm khí Y có tỉ khối so với H2 là 13. Lấy 2,479 lít (đo ở điều kiện chuẩn) khí Y đem đốt cháy rồi cho toàn bộ sản phẩm cháy đó đi qua 100 ml dung dịch H2O2 5,1% (có khối lượng riêng bằng 1gam/mL), sau phản ứng thu được dung dịch B. Các phản ứng xảy ra hoàn toàn.
a) Tính thành phần % khối lượng các chất trong hỗn hợp X.
b) Xác định nồng độ % các chất trong dung dịch B.
—— HẾT ——
Cán bộ coi thi không giải thích gì thêm
CBCT 1:…………………………………………….. CBCT 2:……………………………………….
O2 Education gửi các thầy cô link download đề thi
Các thầy cô có thể xem thêm nhiều đề thi hsg của các tỉnh khác tại
Tổng hợp đề thi hsg lớp 10 môn hoá học
Đề thi hsg môn hóa lớp 10 tỉnh Hà Nam năm 2023 2024
UBND TỈNH HÀ NAM SỞ GIÁO DỤC VÀ ĐÀO TẠO | KỲ THI CHỌN HỌC SINH GIỎI LỚP 10 THPT CẤP TỈNH NĂM HỌC 2023 – 2024 Môn: Hoá học Thời gian làm bài: 180 phút |
HƯỚNG DẪN CHẤM
Câu 1. (2,0 điểm)
1. Phổ khối lượng (MS: Mass Spectrum) chủ yếu được sử dụng để xác định phân tử khối, nguyên tử khối của các chất và hàm lượng các đồng vị bền của một nguyên tố. Trục tung biểu thị hàm lượng phần trăm về số nguyên tử của từng đồng vị, trục hoành biểu thị tỉ số của nguyên tử khối (m) của mỗi đồng vị với điện tích của các ion đồng vị tương ứng (điện tích z của các đồng vị copper đều bằng 1+).
a) Nguyên tử khối trung bình của copper (Cu) là 63,52. Hình phổ khối nào dưới đây phù hợp với dữ kiện này. Giải thích?
b) Tính hàm lượng trong quặng chalcopyrit CuFeS2 (đây là quặng quan trọng nhất của copper trong tự nhiên). Cho Fe = 56, S = 32.
2. Hợp chất A được tạo từ các ion đơn nguyên tử đều có cấu hình electron là 1s22s22p63s23p6 (giá trị tuyệt đối điện tích của các ion đều 3). Trong một phân tử của A có tổng số hạt cơ bản (p, n, e) là 164. Biện luận xác định tên của A. Biết trong một phân tử của A có p n 1,52.p.
Cho O (Z = 8), F (Z = 9), Cl (Z = 17), Na (Z = 11), K (Z = 19), S (Z = 16).
| Câu 1 | Nội dung | Điểm |
| 1. a) | Hình C phù hợp với dữ kiện vì theo hình C, copper có 2 đồng vị 63Cu và 65Cu. Nguyên tử khối trung bình của Cu là: gam/mol | 0,5 |
| b) | Hàm lượng trong quặng chalcopyrit CuFeS2 là: | 0,5 |
| 2 | – Từ giả thiết Tổng số electron trong mỗi ion là 18 Gọi a là số lượng ion trong A, N là tổng số neutron trong A Tổng số electron trong A là 18a = tổng số proton 164 = 2.18a + N N = 164 – 36a – Trong một phân tử A có: 18a 164 – 36a 1,52. 18a 2,59 a 3,03 a = 3 A có dạng M2X hoặc MX2 | 0,5 |
| – Nếu A có dạng M2X Các ion tạo A là M+ và X2- Do: M+ có cấu hình 1s22s22p63s23p6 M có cấu hình electron: 1s22s22p63s23p64s1 Þ M là Potassium (K). X2- có cấu hình 1s22s22p63s23p6 X có cấu hình electron: 1s22s22p63s23p4 Þ X là Sulfur (S). A là K2S (Potassium sulfide) | 0,25 | |
| – Nếu A có dạng MX2 Các ion tạo A là M2+ và X– Do: M2+ có cấu hình 1s22s22p63s23p6 M có cấu hình electron: 1s22s22p63s23p64s2 M là Calcium (Ca). X– có cấu hình 1s22s22p63s23p6 Þ X có cấu hình electron: 1s22s22p63s23p5 X là Chlorine (Cl). A là CaCl2 (Calcium chloride). | 0,25 |
Câu 2. (2,0 điểm)
1. Nguyên tử hydrogen và các ion giống hydrogen (ví dụ He+) là hệ 1 electron, 1 hạt nhân. Năng lượng của electron trong hệ này được tính theo biểu thức:
Với: n là số lượng tử chính, cho biết mức năng lượng của electron (n = 1, 2, 3,…) ; Z là số đơn vị điện tích hạt nhân.
Trạng thái cơ bản là trạng thái electron có năng lượng thấp nhất (n = 1). Năng lượng ion hoá là năng lượng cần cung cấp để tách electron ở trạng thái cơ bản ra khỏi nguyên tử hoặc ion (n = ¥).
a) Tính năng lượng ion hoá thứ nhất của hydrogen và năng lượng ion hoá thứ 2 của helium theo đơn vị eV và kJ/mol. Cho ZH = 1; ZHe = 2; 1eV = 1,602.10-19 J; NA = 6,022.1023. E¥ = 0.
b) Khi chuyển từ các trạng thái có năng lượng cao về trạng thái có mức năng lượng thấp hơn, nguyên tử hay ion sẽ phát ra năng lượng dưới dạng bức xạ điện từ ứng với các bước sóng nhất định. Các bước sóng này được ghi lại (các vạch) và gọi là quang phổ phát xạ.
Xác định bước sóng (l) theo nm của bức xạ điện từ phát ra khi electron trong nguyên tử hydrogen chuyển từ trạng thái có mức năng lượng cao hơn (n = 3) về trạng thái có mức năng lượng thấp hơn (n = 2).
Cho biết năng lượng của bức xạ điện từ được tính theo hệ thức Einstein:
với h = 6,626.10-34 J.s; c = 3.108m.s-1; 1 eV = 1,602.10-19 J.
2. Ba nguyên tố X, Y, Z thuộc cùng một chu kì và có tổng số hiệu nguyên tử là 39. Số hiệu nguyên tử Y bằng trung bình cộng số hiệu của nguyên tử X và Z. Nguyên tử của ba nguyên tố nguyên hầu như không phản ứng với H2O ở điều kiện thường.
a) Viết cấu hình electron nguyên tử của X, Y, Z, xác định số electron độc thân trong mỗi nguyên tử ở trạng thái cơ bản.
b) So sánh độ âm điện, bán kính nguyên tử X, Y, Z.
c) So sánh tính base của các hydroxide ứng với oxide cao nhất của X, Y, Z.
Cho: Na (Z = 11), K (Z = 19), S (Z = 16), Mg (Z = 12), Al (Z = 13), Si (Z = 14).
| Câu 2 | Nội dung | Điểm |
| 1.a) | – Với nguyên tử hydrogen Z = 1. Trạng thái cơ bản n = 1: – Với ion He+ có ZHe = 2. Trạng thái cơ bản n = 1: | 0,25 0,25 |
| b) | – Khi electron chuyển từ mức năng lượng n = 3 về mức n = 2 phát ra bức xạ có năng lượng: | 0,5đ |
| 2. | a) Gọi số hiệu nguyên tử của các nguyên tố X, Y, Z lần lượt là p1, p2, p3. Trong đó p1 < p2 < p3, ta có: p1 + p2 + p3 = 39 (1) và (2) Giải hệ (I) và (II), ta được p2 = 13 Þ Y là Aluminium (Al) Þ Cấu hình electron của Y: 1s22s22p63s23p1, số electron độc thân = 1. Ta có p1 < 13 < p3 và X, Y, Z thuộc cùng một chu kì nên p1 ³ 11 Þ p1 = 11 hoặc p1 = 12. Khi p1 = 11 Þ X là Na (sodium) không phù hợp vì Na tác dụng với nước ngay ở nhiệt độ thường. Vậy X Þ Mg (magnesium), có p1 = 12 và cấu hình electron: 1s22s22p63s2 (số electron độc thân = 0). Þ p3 = 14 Þ Z là Si (silicon), có cấu hình electron: 1s22s22p63s23p2 (số electron độc thân = 2). | 0,25 0,25 |
| b) Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, độ âm điện của các nguyên tố tăng dần, bán kính nguyên tử giảm dần: – Độ âm điện: 12Mg < 13Al < 14Si. – Bán kính nguyên tử: 12Mg > 13Al > 14Si. | 0,25 | |
| c) Tính base: Mg(OH)2 > Al(OH)3 > H2SiO3 Mg(OH)2 là một base yếu, Al(OH)3 là hydroxide lưỡng tính và H2SiO3 là một acid yếu. | 0,25 |
1. Dựa vào mô hình lực đẩy giữa các cặp electron vỏ hoá trị (VSERP: Valence Shell Electron Pair Repulsion) và thuyết lai hóa.
Viết công thức Lewis, dự đoán dạng hình học và trạng thái lai hóa của nguyên tử trung tâm của các phân tử sau (có giải thích): SO2; CO2; CH4; SOCl2, PCl5.
Cho: S (Z = 16); O (Z = 8); P (Z = 15); C (Z=6); Cl (Z=17); H (Z =1).
2. ChoX, Y, Z là các hợp chất ion thuộc trong số các chất sau: MgO, MgF2 và NaF. Nhiệt độ nóng chảy của các hợp chất X, Y, Z được thể hiện qua biểu đồ:
Nhiệt độ nóng chảy của hợp chất ion là nhiệt độ tại đó có đủ năng lượng dưới dạng nhiệt để phá vỡ lực hút tĩnh điện mạnh giữa các ion và phá vỡ cấu trúc mạng tinh thể chuyển từ thể rắn sang thể lỏng. Hợp chất ion có liên kết bền hơn sẽ có nhiệt độ nóng chảy cao hơn.
Trình bày cách xác định X, Y, Z.
| Câu 3 | Nội dung | Điểm |
| 1. | Phân tử Công thức Lewis Công thức VSEPR Trạng thái lai hóa của NTTT Dạng hình học của phân tử SO2 AX2E1 sp2 Gấp khúc (Góc, chữ V) CO2 AX2 sp Đường thẳng SOCl2 AX3E1 sp3 Tháp tam giác CH4 AX4E sp3 Tứ diện PCl5 AX5E0 sp3d Lưỡng tháp tam giác | 1,25 |
| 2. | – Do điện tích O2- lớn hơn điện tích của F–, trong khi bán kính anion O2- và F– là khác biệt không đáng kể (O và F cùng thuộc chu kì 2) nên hợp chất MgO bền hơn MgF2. Do đó MgF2 phải có nhiệt độ nóng chảy thấp hơn MgO. – Do điện tích Mg2+ lớn hơn điện tích của Na+, trong khi bán kính Mg2+ lại nhỏ hơn bán kính Na+ nên MgF2 bền hơn NaF. Do đó NaF phải có nhiệt độ nóng chảy thấp hơn MgF2 ⇒ Nhiệt độ nóng chảy: NaF < MgF2 < MgO Vậy X là NaF; Y là MgF2 và Z là MgO. | 0,25 0,25 0,25 |
Câu 4. (2,0 điểm)
1. Đồng vị dùng trong y học để điều trị bệnh ung thư tuyến giáp thường được điều chế bằng cách bắn phá bia chứa bằng neutron trong lò phản ứng hạt nhân. Trong phương pháp này, trước tiên nhận 1 neutron chuyển hóa thành , rồi đồng vị này phân rã tạo thành .
a) Viết phương trình các phản ứng hạt nhân xảy ra khi điều chế .
b) Trong thời gian 3 giờ, 1 mL dung dịch ban đầu phát ra 1,08.1014 hạt .
– Tính nồng độ ban đầu của trong dung dịch theo đơn vị mmol/L.
– Sau bao nhiêu ngày, hoạt độ phóng xạ riêng của dung dịch chỉ còn 103 Bq/mL?
Biết chu kì bán hủy của là 8,02 ngày. Cho NA = 6,022.1023.
2. Trong khảo cổ, người ta dùng đồng vị phân rã b– (có chu kỳ bán huỷ t1/2 = 5730 năm) để xác định các mẫu vật hữu cơ bị chết trong khoảng cách đây 500 đến 50.000 năm.
Trong hành trình du lịch bằng du thuyền vào năm 2016, Anna và nhóm bạn đã nhặt được 1 chai thủy tinh bên trong có 2 mảnh gỗ thuôn dài với hoa văn tinh xảo và các ký tự kỳ quái, họ rất tò mò nên đã tìm đến trung tâm khảo cổ để nhờ giúp đỡ. Sau một tuần nghiên cứu về hoa văn và ký tự các nhà khảo cổ đã nhận định mẫu vật có thể có khoảng hơn 13 400 năm về trước, nhưng để có cơ sở vững chắc các nhà khảo cổ đã thực hiện thí nghiệm đo hoạt độ phóng xạ của mẫu và ghi nhận được hoạt độ phóng xạ của mẫu là 48 Bq/kg C, biết hoạt độ phóng xạ của 14C trong cơ thể sống là 224 Bq/kg C.
a) Viết quá trình phân rã của (cho ZN = 7, ZO = 8).
b) Hãy tính tuổi của mẫu gỗ.
Sử dụng các công thức sau trong tính toán:
Trong đó: A0 là hoạt độ phóng xạ ban đầu của chất (số phân rã trong 1 giây, Bq).
A là hoạt độ phóng xạ của chất tại thời điểm t .
N0: số nguyên tử chất phóng xạ tại thời điểm ban đầu.
N: số nguyên tử chất phóng xạ tại thời điểm t.
k: hằng số phân rã.
t1/2: chu kỳ bán huỷ.
| Câu 4 | Nội dung | Điểm |
| 1. a) | 0,5 | |
| b) | Gọi N0 là số nguyên tử có trong 1 ml dung dịch ban đầu. N là số nguyên tử có trong 1 mL dung dịch sau thời gian t. Ta có: Số hạt phát ra trong thời gian t = 3 giờ là: (nguyên tử) Nồng độ ban đầu của trong dung dịch là: | 0,5 |
| c) | Hoạt độ phóng xạ riêng (tính cho 1 mL dung dịch) ban đầu là: Thời gian để hoạt độ phóng xạ riêng của dung dịch chỉ còn 103 Bq/mL là: (ngày) | 0,25 |
| 2. a) | 0,25 | |
| b) | Tuổi của mẫu gỗ là: năm | 0,5 |
Câu 5. (2,0 điểm)
1. Nhiệt độ sôi của các hợp chất với hydrogen của các nguyên tố nhóm VA, VIA và VIIA được biểu diễn qua đồ thị sau:
a) Giải thích tại sao nhiệt độ sôi của H2O, HF, NH3 cao bất thường so với các hợp chất với hydrogen của các nguyên tố còn lại trong nhóm?
b) Nhận xét nhiệt độ sôi các hợp chất với hydrogen của các nguyên tố còn lại ở mỗi nhóm và giải thích nguyên nhân sự biến đổi nhiệt độ sôi của chúng.
2. Hoàn tan hết 1,74 gam hỗn hợp có chứa kim loại barium và hai kim loại kiềm kế tiếp nhau trong nhóm IA của bảng tuần hoàn vào nước, thu được dung dịch X và 619,4 mL (25 oC và 1 bar). Nếu thêm 1,278 gam Na2SO4 vào dung dịch X và khuấy đều thì sau khi phản ứng kết thúc, nước lọc vẫn còn ion Ba2+. Nếu thêm 1,562 gam Na2SO4 vào dung dịch X và khuấy đều thì sau khi phản ứng kết thúc, nước lọc có mặt ion . Xác định tên 2 kim loại kiềm ở trên. Cho Li = 7; Na = 23; K = 39; Rb = 85,5; Cs = 133; Ba = 137.
| Câu 5 | Đáp án | Điểm |
| 1. a) | Nhiệt độ sôi của H2O HF, NH3 cao bất thường do tạo được liên kết hydrogen liên phân tử. , , H – F ….H – F | 0,5 |
| b) | Nhiệt độ sôi của các hợp chất còn lại trong dãy tăng dần do tăng phân tử khối, lực tương tác Van der Walls tăng. | 0,5 |
| 2. | Kí hiệu hai kim loại kiềm kế tiếp là M, có nguyên tử khối trung bình là . Ba + 2H2O → Ba(OH)2+ H2 2M + 2H2O → MOH+ H2 Ba(OH)2 + Na2SO4 → BaSO4 ¯ + 2 NaOH Þ Khi thêm 0,009 mol Na2SO4thì Ba2+ dư còn khi thêm 0,011 mol Na2SO4 thì dư, Ba2+ hết. Coi số mol Ba và M lần lượt là x và y. Với 0,009 < x < 0,011 Þ 0,028 < y < 0,032. Þ 0,028 < < 0,032 Þ 8,32 < < 15,84. ⇒ Hai kim loại kiềm thỏa mãn đề bài là Lithium (7) và Sodium (23). | 0,25 0,25 0,5 |
Câu 6. (2,0 điểm)
1. Kim loại calcium kết tinh theo mạng lập phương tâm diện. Cấu trúc tinh thể của calcium được mô tả như hình sau:
Bán kính nguyên tử của calcium rCa = 197pm. Tính khối lượng riêng của calcium kim loại theo đơn vị gam/cm3.
2. Calcium chloride được sử dụng trong công nghiệp thực phẩm, dược phẩm để điều trị bệnh thiếu calcium ở người. Calcium chloride có khối lượng riêng r = 2,19 g.cm-3, với cấu trúc tứ phương (lăng trụ đứng, đáy hình chữ nhật): a = 6,26 Å; b = 6,44 Å và c = 4,17 Å. Xác định số lượng phân tử CaCl2 trong một ô mạng cơ sở. Cho Ca = 40,0 gam/mol; Cl = 35,5 gam/mol; NA = 6,022.1023.
| Câu 6 | Nội dung | Điểm |
| 1. | Ta có Ca kết tinh theo mạng lập phương tâm diện. – Số nguyên tử Ca trong 1 ô mạng cơ sở là: 8.1/8 + 6.1/2 = 4 (nguyên tử) – Các nguyên tử Ca tiếp xúc với nhau trên đường chéo của mỗi mặt hình lập phương cạnh a: Khối lượng riêng của Ca: | 1,0 |
| b) | Gọi số phân tử CaCl2 trong 1 ô mạng cơ sở là N. – Khối lượng riêng của CaCl2 được tính theo công thức: | 1,0 |
Câu 7. (2,0 điểm)
1. Xác định số oxi hoá của các nguyên tử trong các chất sau:
; ; ;
2. Cho hai ví dụ về phản ứng hoá học (nêu ứng dụng thực tế của các phản ứng đó (nếu có)) đối với mỗi trường hợp trong đó:
a) có 2 nguyên tố cùng là chất khử và cả 2 đều có trong thành phần của một chất.
b) có nguyên tố ở một mức oxi hoá ban đầu, vừa là chất khử vừa là chất oxi hoá.
c) có 2 nguyên tố là chất oxi hoá và chất khử đều có trong thành phần của một chất.
| Câu 7 | Hướng dẫn | Điểm |
| 1. | ; ; ; | 0,25 x 4 = 1,0 |
| 2.a) | Có 2 nguyên tố cùng là chất khử và cả 2 đều có trong thành phần của một chất. Ví dụ: 4FeS(s) + 11 O2(g) 2Fe2O3(s) + 8SO2(g) (đốt cháy quặng pyrite trong quá trình sản xuất sulfuric acid). 4FeS + 7O2 2Fe2O3 + 4SO2 | 0,5 |
| b) | Có nguyên tố ở một mức oxi hoá ban đầu, vừa là chất khử vừa là chất oxi hoá. Ví dụ: Cl2 + 2NaOH ® NaCl + NaClO + H2O (Phản ứng điều chế nước Javen). 2NO2 + 2NaOH ® NaNO3 + NaNO2 + H2O | 0,25 |
| c) | – Phản ứng điều chế khí oxygen trong phòng thí nghiệm: 2KMnO4 K2MnO4 + MnO2 + O2 2KClO3 2KCl + 3O2 | 0,25 |
Câu 8. (2,0 điểm)
1. Muối ăn khi khai thác từ nước biển, mỏ muối, hồ muối thường có lẫn nhiều tạp chất như MgCl2, CaCl2, CaSO4 làm cho muối có vị đắng chát và dễ bị chảy nước gây ảnh hưởng xấu tới chất lượng muối. Một trong những phương pháp loại bỏ tạp chất ở muối ăn là dùng hỗn hợp A gồm Na2CO3, NaOH, BaCl2 tác dụng với dung dịch nước muối để loại tạp chất dưới dạng các chất kết tủa CaCO3, Mg(OH)2, BaSO4. Một mẫu muối thô thu được bằng phương pháp bay hơi nước biển vùng Ninh Thuận có thành phần khối lượng như sau: 96,525% NaCl; 0,190% MgCl2; 1,224% CaSO4; 0,010% CaCl2; 0,951% H2O.
a) Viết các phương trình hoá học xảy ra khi dùng hỗn hợp A để loại bỏ tạp chất có trong mẫu muối trên.
b) Tính khối lượng A cần dùng để loại bỏ hết tạp chất có trong 3 tấn muối nói trên.
c) Tính thành phần % về khối lượng của các chất trong A. Giả sử các phản ứng xảy ra hoàn toàn.
2. Cho 4,32 gam hỗn hợp X gồm Mg và MgO vào dung dịch chứa 0,15 mol H2SO4 đặc, sau phản ứng thu được 0,7437 lít khí SO2 (đkc, khí duy nhất), dung dịch Y chỉ chứa muối trung hòa và 1,8 gam hỗn hợp rắn Z. Lọc, sấy khô Z rồi đem đốt trong không khí đến phản ứng hoàn toàn thu được chất rắn có khối lượng không đổi so với Z. Tính thành phần phần trăm khối lượng các chất trong hỗn hợp X và hỗn hợp Z.
Cho: Ca = 40; Na = 23; Ba = 137; S = 32; O = 16; Mg = 24; Cl = 35,5.
| Ý | Đáp án | Điểm |
| 1. a) | MgCl2 + 2NaOH® Mg(OH)2¯ + 2NaCl (1) CaSO4 + BaCl2 ® BaSO4¯ + CaCl2 (2) CaCl2 + Na2CO3 ® CaCO3¯ + 2NaCl (3) | 0,25 |
| b) | Trong 3 tấn muối trên chứa: Từ PTHH (1): Khối lượng NaOH cần dùng là: 40. (5,7 : 95) = 2,4 (kg) Từ PTHH (2): Khối lượng BaCl2 cần dùng là: 208. (36,72 : 136) = 56,16 (kg) Từ PTHH (3): Khối lượng Na2CO3 cần dùng là: 106.[(0,3 : 111) + (36,72 : 136)] = 28,91 (kg). | 0,25 |
| Vậy khối lượng A cần dùng để loại bỏ hết tạp chất trong 3 tấn muối trên là: mA =2,4 + 56,16 + 28,91 = 87,47 kg | 0,25 | |
| c) | Phần trăm khối lượng mỗi chất trong A là: %m NaOH= 2,74 %; = 64,21 %; = 33,05%. | 0,25 |
| 2. | Do đốt Z trong không khí thu được chất rắn có khối lượng không đổi so với Z nên Z chứa Mg dư và S, có thể có MgO dư Đặt a, b lần lượt là số mol Mg và MgO trong X, c là mol MgSO4 trong dung dịch Y Theo đề ta có sơ đồ | 0,25 |
| BTNT H nên Bảo toàn khối lượng: 4,32 + 0,15.98 = 0,15.18 + 0,03.64 + 120c + 1,8 Þ c = 0,105 (mol) Do đốt Z trong không khí thu được chất rắn (chính là MgO) có khối lượng không đổi so với Z nên mZ = mMgO → nMgO = 1,8 : 40 = 0,045 mol Ta có: %S = 26,67% | 0,25 | |
| * Thành phần phần trăm khối lượng các chất trong X: %mMg = 0,105.24/4,32 . 100% = 58,33% %mMgO = 41,67% | 0,25 | |
| * Thành phần phần trăm khối lượng các chất trong Z: BTNT O: nMgO(Z) = 0,045 + 0,15.4 – 0,105.4 – 0,03.2 – 0,15 = 0,015 mol nMg(Z) = 0,045 – 0,015 = 0,03 mol nS(Z) = 0,15 – 0,03 – 0,105 = 0,015 mol Vậy trong Z: %MgO = 0,015.40/1,8 .100% = 33,33% %Mg = 0,03.24/1,8 .100% = 40% | 0,25 |
Câu 9. (2,0 điểm)
1. Bạn biết không, “gas” trong bật lửa ga thực chất là hỗn hợp propane (C3H8) và butane (C4H10) (tên thương mại là “propane”). “Gas” là một phân đoạn của dầu mỏ, được thêm lượng nhỏ phụ gia là có thể bơm vào bật lửa ga, bếp ga thậm chí cả ô tô. Để bảo quản, hỗn hợp khí được nén ở -430C dưới áp suất 1,6 MPa cho hỗn hợp lỏng với khối lượng riêng rL =0,547 g.ml-1; hỗn hợp lỏng hoá hơi cho hỗn hợp khí có khối lượng riêng rg = 4,03 g.L-1 ở 200C và 2 atm.
Để vận chuyển “gas” lỏng thường chứa trong các bồn thể tích 86,7 m3. Cho biết enthalpy tạo thành chuẩn (kJ.mol-1) các chất được cho trong bảng:
| Chất | CO2(g) | H2O(g) | C3H8(g) | C4H10(g) |
| (kJ.mol-1) | -393,5 | -241,8 | -103,9 | -126,2 |
1. Viết phương trình phản ứng xảy ra khi đốt cháy hoàn toàn “gas”. Biết propane (C3H8(g)) và butane (C4H10(g)) cháy đều tạo ra CO2(g) và H2O(g).
2. Tính biến thiên enthalpy cho hai phản ứng trên ở điều kiện chuẩn.
3. Xác định lượng nhiệt toả ra (kJ) khi đốt cháy hoàn toàn “gas” trong một bồn đầy.
| Câu 9 | Nội dung | Điểm |
| 1. | Phản ứng đốt cháy gas: | 0,5 |
| 2. | Xét phản ứng: – Xét phản ứng: | 0,5 |
| 3. | – Trong bồn đầy thể tích 86,7 m3 có khối lượng hỗn hợp là : mhỗn hợp = 0,547.86,7.106 = 47,4249.106 (gam) Hỗn hợp khí có: Ta có: Lượng nhiệt toả ra khi đốt cháy gas trong bồn đầy: | 0,5 0,5 |
Câu 10. (2,0 điểm)
Phân tích nhiệt trọng là kĩ thuật phân tích để xác định thành phần của các chất rắn bị phân huỷ khi đun nóng. Sự thay đổi khối lượng được đo trong quá trình đun nóng sẽ cung cấp thông tin về thành phần của chất cần phân tích. Đun nóng hỗn hợp calcium oxalate và magnesium oxalate đến 9000C. Trong quá trình này, khối lượng hỗn hợp được đo liên tục. Biết rằng có 2 phản ứng phân huỷ ở khoảng 4000C:
Ở 7000C quan sát được phản ứng phân huỷ thứ 3.
1. Viết phương trình phản ứng phân huỷ thứ 3.
2. Ở 5000C, khối lượng hỗn hợp rắn đo được là 3,06 gam, ở 9000C là 2,03 gam. Tính phần trăm khối lượng của các chất trong mẫu ban đầu trước khi đun nóng. Cho Ca = 40,08; Mg = 24,0; C = 12,0; O = 16,00.
3. Nhà hoá học đã tiến hành phép phân tích ở ý 2 muốn kiểm tra tính chính xác của phương pháp phân tích trọng lượng. Do đó, ông đã thử xác định khối lượng mol của carbon và so sánh nó với giá trị trong tài liệu tham khảo. Ông đã nung nóng 7,30 gam calcium oxalate để nhận được dữ kiện sau:
| Nhiệt độ (0C) | 90 | 250 | 500 | 900 |
| Khối lượng (gam) | 7,30 | 6,40 | 5,00 | 2,80 |
Giải thích nguyên nhân cho sự giảm khối lượng đầu tiên. Tính khối lượng mol của carbon dựa vào dữ liệu trên. Giả sử khối lượng mol của calcium và oxygen lần lượt là 40,08 và 16,00 g/mol.
| Câu 10 | Nội dung | Điểm |
| 1. | Phản ứng phân huỷ thứ 3: | 0,25 |
| 2. | Gọi số mol MgC2O4 và CaC2O4 trong hỗn hợp đầu lần lượt là x và y mol. Các phản ứng: – Ở 5000C: xảy ra phản ứng (1) và (2). Chất rắn thu được gồm MgO và CaCO3. – Ở 9000C xảy ra thêm phản ứng (3). Chất rắn thu được gồm MgO và CaO. Ta có: Thành phần mẫu ban đầu: | 0,25 0,5 |
| 3. | Sự giảm khối lượng đầu tiên là do mất nước: Gọi khối lượng mol của C là a (gam/mol) Vậy khối lượng mol của carbon là 12,06 g/mol. | 0,5 0,5 |
——— HẾT——–
O2 Education gửi các thầy cô link download đề thi
Các thầy cô có thể xem thêm nhiều đề thi hsg của các tỉnh khác tại
Tổng hợp đề thi hsg lớp 10 môn hoá học
Đề thi hsg môn hóa lớp 10 tỉnh Thái Bình năm 2023 2024 đề minh họa
| SỞ GIÁO DỤC VÀ ĐÀO TẠO THÁI BÌNH (Đề gồm 5 trang) | ĐỀ MINH HỌA KỲ THI CHỌN HỌC SINH GIỎI LỚP 10 THPT NĂM HỌC 2023-2024 Môn: HÓA HỌC Thời gian làm bài: 120 phút(không kể thời gian giao đề) |
Họ và tên thí sinh…………………………………….
| Mã đề thi 217 |
Số báo danh: …………………………………………
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn.
Thí sinh trả lời từ câu 1 đến câu 15.Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1: Cho nguyên tử nguyên tố X có tổng số electron trong phân lớp p là 11, nguyên tử nguyên tố Y có số hạt mang điện nhiều hơn số hạt mang điện của X là 4 hạt. Cho các phát biểu về nguyên tố X,Y:
(1) X có 5 electron ở lớp ngoài cùng, Y có 1 electron lớp ngoài cùng.
(2) Ở trạng thái cơ bản nguyên tố X, Y đều có 1 electron độc thân.
(3) X là phi kim, Y là kim loại.
(4) X, Y đều là nguyên tố p.
(5) X có số hiệu nguyên tử là 17, Y có số hiệu nguyên tử là 19.
Số phát biểu đúng là
A. 2. B. 3. C. 4. D. 5.
Câu 2. Năm 1911, Rơ-đơ-pho (E. Rutherford) và các cộng sự đã dùng các hạt α bắn phá lá vàng mỏng và dùng màn huỳnh quang đặt sau lá vàng để theo dõi đường đi của các hạt α. Kết quả thu được
– Hầu hết các hạt α xuyên thẳng qua lá vàng.
– Một số ít hạt α bị lệch quỹ đạo so với ban đầu.
– Một số rất ít hạt α bị bật ngược trở lại.
Kết quả thí nghiệm đã rút ra các kết luận về nguyên tử như sau:
(1) Nguyên tử có cấu tạo rỗng.
(2) Hạt nhân nguyên tử có kích thước rất nhỏ so với kích thước nguyên tử.
(3) Hạt nhân nguyên tử mang điện tích âm, khối lượng lớn.
(4) Xung quanh nguyên tử là các electron chuyển động tạo nên lớp vỏ nguyên tử.
Số kết luận sai là:
A. 1. B. 2. C. 3. D. 4.
Câu 3. Phổ khối lượng của zirconium được biểu diễn như hình sau đây (điện tích Z của các ion đồng vị zirconium đều bằng 1+). Số lượng đồng vị bền và nguyên tử khối trung bình của zirconium là:
A. 5 đồng vị, nguyên tử khối trung bình bằng 92,60.
B. 5 đồng vị, nguyên tử khối trung bình bằng 91,32.
C. 4 đồng vị, nguyên tử khối trung bình bằng 91,18.
D. 4 đồng vị, nguyên tử khối trung bình bằng 92,00.
Câu 4: Theo quy luật biến đổi tính chất các đơn chất trong bảng tuần hoàn thì:
A. Kim loại mạnh nhất là sodium B. Phi kim mạnh nhất là chlorine
C. Phi kim mạnh nhất là oxygen D. Phi kim mạnh nhất là florine
Câu 5: Xét phân tử H2O, có bao nhiêu phát biểu đúng trong các phát biểu sau?
(a) Trong phân tử H2O chỉ chứa liên kết đơn.
(b) Phân tử H2O là phân tử phân cực.
(c) Cặp electron dùng chung trong liên kết H-O lệch về phía nguyên tử O.
(d) Khi hình thành liên kết mỗi nguyên tử H nhường 1 electron cho O, mỗi nguyên tử O nhận thêm 2 electron của H.
(e) Nguyên tử O còn hai cặp electron hoá trị riêng.
A. 2 B. 3 C. 4 D. 5
Câu 6: Biết số hiệu nguyên tử của hai nguyên tố X và Y lần lượt là 19 và 17. Cho các phát biểu sau:
(a) Độ âm điện của nguyên tử X nhỏ hơn độ âm điện của nguyên tử Y.
(b) Trạng thái cơ bản số electron độc thân của nguyên tử X ít hơn số electron độc thân của nguyên tử Y.
(c) Trong các phản ứng hóa học, nguyên tử X có xu hướng nhường 2 electron.
(d) Khi hình thành liên kết với nguyên tử X, nguyên tử Y nhận 1 electron.
Số phát biểu đúng là
A. 2. B. 3. C. 1. D. 4.
Câu 7: Cho phản ứng sau: Fe3O4 + HNO3 Fe(NO3)3 + NO + H2O
Hệ số cân bằng của HNO3 trong phương trình hoá học trên là bao nhiêu ?
A. 30 B. 28 C. 10 D. 4
Câu 8: Cho phản ứng: 2FeCl2 + Cl2 → 2FeCl3
Trong phản ứng trên:
A. Ion Fe2+ bị khử và nguyên tử Cl bị oxi hóa. B. Ion Fe3+ bị khử và ion Cl– bịoxi hóa.
C. Ion Fe2+ bị oxi hóa và nguyên tử Cl bị khử. D. Ion Fe3+ bị oxi hóa và ion Cl– bị khử.
Câu 9: Cho bảng giá trị ΔfHo298 của một số chất:
| Chất | H2O (l) | H2O (g) | SO2 (g) | H2S (g) |
| ΔfHo298 (kJ mol-1) | –285,83 | –241,82 | –296,83 | –20,63 |
Tính ΔrHo298 của phản ứng 2H2S(g) + 3O2 (g) à 2SO2 (g) + 2H2O(g) ?
A. –1036,04 kJ. B. 1063,04 kJ. C. –1036,40 kJ. D. 1036,04 kJ.
Câu 10: Mô tả nào sau đây là đúng theo phương trình nhiệt hóa học sau :
1/2 N2 (g) + 1/2 O2 (g) → NO (g) ; ∆rH0298 = + 179,20 kJ
A. Ở điều kiện chuẩn, phản ứng của ½ mol N2(thể khí) với ½ mol O2 (thể khí) thu được 1 mol NO (thể khí) và giải phóng (tỏa ra) một lượng nhiệt là 179,20 kJ, ta nói enthalpy tạo thành chuẩn của NO (thể khí) là -179,20 kJ/mol.
B. Ở điều kiện chuẩn, phản ứng của ½ mol N2(thể khí) với ½ mol O2 (thể khí) thu được 1 mol NO (thể khí) và hấp thu một lượng nhiệt là 179,20 kJ, ta nói enthalpy tạo thành chuẩn của NO (thể khí) là +179,20 kJ/mol.
C. Ở điều kiện chuẩn, phản ứng của 1 mol N2(thể khí) với 1 mol O2 (thể khí) thu được 2 mol NO (thể khí) và hấp thu một lượng nhiệt là 179,20 kJ, ta nói enthalpy tạo thành chuẩn của NO (thể khí) là +179,20 kJ/mol.
D. Ở điều kiện chuẩn, phản ứng của ½ mol N2(thể khí) với ½ mol O2 (thể khí) thu được 1 mol NO (thể khí) và giải phóng (tỏa ra) một lượng nhiệt là 179,20 kJ, ta nói enthalpy tạo thành chuẩn của NO (thể khí) là -179,20 kJ/mol.
Câu 11: Thí nghiệm nghiên cứu tốc độ phản ứng zinc (Kẽm) với dung dịch hydrochloric acid của hai nhóm học sinh được mô tả bằng hình sau :
Kết quả cho thấy bọt khí thoát ra ở thí nghiệm của nhóm thứ hai mạnh hơn là do :
A. Nhóm thứ hai dùng acid nhiều hơn.
B. Diện tích bề mặt zinc bột lớn hơn zinc miếng.
C. Nồng độ zinc bột lớn hơn.
D. Áp suất tiến hành thí nghiệm nhóm thứ hai cao hơn nhóm thứ nhất.
Câu 12: Ở 30oC sự phân hủy H2O2 xảy ra theo phản ứng: H2O2 ® H2O + ½ O2
Dựa vào bảng số liệu sau, hãy tính tốc độ trung bình của phản ứng trong khoảng 120 giây đầu tiên.
| Thời gian, s | 0 | 60 | 120 | 240 |
| Nồng độ H2O2, mol/l | 0,3033 | 0,2610 | 0,2330 | 0,2058 |
A. 2,929.10−4 mol.(l.s)−1 B. 5,858.10−4 mol.(l.s)−1
C. 4,667.10−4 mol.(l.s)−1 D. 2,333.10−4 mol.(l.s)−1
Câu 13: Sulfur được sử dụng trong quá trình lưu hóa cao su, làm chất diệt nấm và có trong thuốc nổ đen. Sulfur là nguyên tố nhóm VIA. Cho các phát biểu sau về sulfur:
1. Công thức oxide cao nhất là SO3
2. Nguyên tử S có 6 electron hoá trị có số oxi hoá cao nhất là +6.
3. S là nguyên tố kim loại.
4. S tạo hydroxide có dạng H2SO4 và có tính acid mạnh.
Số phát biểu đúng là?
A. 1. B. 2. C. 3. D. 4.
Câu 14: Cho các phát biểu sau:
1) Nguyên tử Na (Z=11) nhường đi 1 electron lớp ngoài cùng tạo thành ion Na+.
2) Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
3) Ion đơn nguyên tử là ion tạo nên từ nhiều nguyên tử
4) Phân tử CO2 là phân tử phân cực.
5) Liên kết trong phân tử HCl được hình thành nhờ sự xen phủ orbital s-p.
Số phát biểu đúng là:
A. 2. B. 5. C. 4. D. 3.
Câu 15: Nhiên liệu được sử dụng phổ biến cho động cơ đốt trong là xăng bao gồm hỗn hợp nhiều chất trong đó hydrocarbon ở thể lỏng là chủ yếu. Nếu giả sử trong xăng chỉ chứa C8H18, cho phương trình nhiệt hóa học của các phản ứng đốt cháy xăng như sau:
C8H18(l) + 12,5O2(g) 8CO2(g) + 9H2O(l)
= – 5016 kJ
Để tránh ô nhiễm môi trường người ta nghiên cứu thay ô tô chạy bằng động cơ nhiên liệu khí hydrogen (H2) cho ô tô chạy bằng động cơ xăng. Để chạy 100 km, ô tô chạy bằng động cơ xăng hết 8,5 lít loại xăng trên, hỏi ô tô chạy bằng động cơ nhiên liệu khí hydrogen cần dùng V m3 khí (đkc). Biết khối lượng riêng của C8H18 là 0,70 kg/L, ∆f (H2O) = – 241,8 kJ/mol, coi hiệu suất động cơ của hai loại ô tô là như nhau. Giá trị của V gần nhất với:
A. 26,8 B. 24,3 C. 53,6 D. 20,2
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 6.Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
Câu 1: Nguyên tố M có trong máu người nồng độ bình thường là 3,5 – 5,0 mmol/l. Trong cơ thể, nguyên tố M giúp điều hòa cân bằng nước và điện giải, giúp duy trì hoạt động bình thường, đặc biệt là của hệ tim mạch, cơ bắp, tiêu hóa, tiết niệu. Trên cơ tim ion M+ làm giảm lực co bóp, giảm tính chịu kích thích và giảm dẫn truyền. Tổng số hạt proton, neutron và electron trong nguyên tử nguyên tố M là 58, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 18.
Nguyên tố X có trong thành phần của các chất có tác dụng oxi hoá và sát khuẩn cực mạnh, thường được sử dụng với mục đích khử trùng và tẩy trắng trong lĩnh vực thuỷ sản, dệt nhuộm, xử lí nước thải, nước bể bơi. Oxide cao nhất của X có công thức là X2O7. Trong hợp chất hydride (hợp chất của X với H) nguyên tố X chiếm 97,26% về khối lượng.
a. Ở trạng thái cơ bản nguyên tử M và nguyên tử X đều có 1 electron độc thân
b. Trong bảng tuần hoàn các nguyên tố hóa học M thuộc chu kì 3, X thuộc chu kì 4.
c. Cho oxide cao nhất của M tác dụng với oxide cao nhất của X thu được hợp chất chứa 46,21% oxygen về khối lượng.
d. Hydroxide tương ứng với oxide cao nhất của X là có tính acid mạnh hơn sulfuric acid.
Câu 2: Sulfur dioxide là một chất có nhiều ứng dụng trong công nghiệp (dùng để sản xuất sulfuric acid, tẩy trắng bột giấy trong công nghiệp giấy, tẩy trắng dung dịch đường trong sản xuất đường tinh luyện,…) và giúp ngăn cản sự phát triển của một số loại vi khuẩn và nấm gây hư hại cho thực phẩm. Ở áp suất 1 bar và nhiệt độ 25 0C, phản ứng giữa 1 mol sulfur với oxygen xảy ra theo phương trình “S(s) + O2(g) SO2(g)” và tỏa một lượng nhiệt là 296,9 kJ.
a. Enthalpy tạo thành chuẩn của sulfur dioxide bằng –296,9 kJ/mol.
b. Sulfur dioxide vừa có thể là chất khử vừa có thể là chất oxi hóa, tùy thuộc vào phản ứng mà nó tham gia.
c. 0,5 mol sulfur tác dụng hết với oxygen giải phóng 148,45 kJ năng lượng dưới dạng nhiệt.
d. 32 gam sulfur cháy hoàn toàn tỏa ra một lượng nhiệt là 2,969.105 J.
Câu 3: Một số loại máy đo nồng độ cồn trong hơi thở dựa trên phản ứng của ethanol (cồn) (C2H5OH) có trong hơi thở với hợp chất potassium dichromate trong môi trường sulfuric acid loãng. Phản ứng (chưa được cân bằng) như sau:
C2H5OH + K2Cr2O7 + H2SO4 CH3COOH + Cr2(SO4)3 + K2SO4 + H2O (1)
Dung dịch chứa ion Cr2O72- ban đầu có màu da cam, khi xảy ra phản ứng (1) dưới tác dụng của chất xúc tác ion Ag+ tạo thành sản phẩm là dung dịch chứa ion Cr3+ có màu xanh lá cây trong khoảng chưa đến 1,0 phút. Dựa vào sự thay đổi màu sắc này có thể xác định người tham gia giao thông có sử dụng thức uống có cồn hay không. Bảng sau (trích từ nghị định 46/2016/NĐ-CP) đưa ra mức độ phạt người tham gia giao thông có sử dụng hàm lượng cồn.
| Mức độ vi phạm | ≤ 0,25 mg cồn / 1 lít khí thở | 0,25 – 0,4 mg cồn / 1 lít khí thở | > 0,4 mg cồn / 1 lít khí thở |
| Xe máy | 2.000.000 – 3.000.000 đồng | 4.000.000 – 5.000.000 đồng | 6.000.000 – 8.000.000 đồng |
Một mẫu hơi thở của anh T bị nghi vấn có sử dụng cồn khi tham gia giao thông có thể tích 52,5 ml được thổi vào thiết bị Breathalyzer chứa 2,0 ml dung dịch K2Cr2O7 nồng độ 0,056 mg/ml trong môi trường acid H2SO4 50% và nồng độ ion Ag+ ổn định 0,25 mg/ml. Biết rằng phản ứng xảy ra hoàn toàn và toàn bộ dung dịch màu da cam chuyển hoàn toàn thành màu xanh lá cây.
a. Cho Cr (Z= 24), O (Z=8). Tổng số electron có trong ion Cr2O72- là 106
b. Tổng hệ số cân bằng nguyên dương tối giản của phản ứng (1)là 31.
c. Trong phản ứng (1) nồng độ chất xúc tác Ag+ giảm đi sau phản ứng.
d. Theo quy định, anh T bị phạt từ 4 đến 5 triệu đồng.
Câu 4: Thực hiện phản ứng hóa học sau: CaCO3 + 2HCl → CaCl2 + CO2#+ H2O
Theo dõi thể tích CO2 thoát ra theo thời gian, thu được đồ thị như sau (thể tích khí được đo ở áp suất khí quyển và nhiệt độ phòng).
a. Ở thời điểm 90 giây, tốc độ phản ứng bằng 0.
b. Tốc độ phản ứng giảm dần theo thời gian.
c. Tốc độ trung bình của phản ứng trong khoảng thời gian từ thời điểm đầu đến 75 giây là 0,33mL/s.
d. Để hoà tan hết một mẫu CaCO3 trong dung dịch acid HCl ở 20oC cần 27 phút. Cũng mẫu CaCO3 đó tan hết trong dung dịch acid nói trên ở 40oC trong 3 phút. Vậy để hoà tan hết mẫu CaCO3 đó trong dung dịch acid nói trên ở 55oC thì cần thời gian 0,5774 phút.
PHẦN III: Câu hỏi tự luận. Thí sinh trình bày phần trả lời từ câu 1 đến câu 5 ra tờ giấy thi.
Câu 1. a) Cho các số liệu nhiệt động của các quá trình chuyển hóa sau (ở 298K)
| STT | Phản ứng | |
| 1 | H2 (g) + Cl2 (g) ® 2HCl (g) | -184,6 |
| 2 | CO2 (g) + H2 (g) ® CO (g) + H2O (g) | 41,13 |
| 3 | COCl2 (g) ® Cl2 (g) + CO (g) | 12,5 |
| 4 | 2NH3 (g) + COCl2 (g) ® CO(NH2)2 (s) + 2HCl (g) | -201 |
| 5 | C (s) + 0,5O2 (g) ® CO (g) | -110,5 |
| 6 | H2 (g) + 0,5O2 (g) ® H2O (g) | -241,87 |
| 7 | CO(NH2)2 (s) + H2O (g) ® CO2 (g) + 2NH3 (g) | ∆H(7) |
Tính enthalpy tạo thành chuẩn (∆fcủa HCl, CO2; COCl2 và ∆H(7)?
b) Cho bảng nhiệt độ sôi của ethanol ( CH3CH2OH ) và dimethyl ether ( CH3OCH3 ).
| Chất | Khối lượng phân tử | Nhiệt độ sôi |
| ethanol | 46 | 78,30C |
| dimethyl ether | 46 | -230C |
Hãy giải thích vì sao hai chất có khối lượng phân tử bằng nhau nhưng nhiệt độ sôi lại khác xa nhau.
Câu 2.
a) Cho các phân tử:PCl3, MgCl2, SO3, Al2O3. Hãy viết sơ đồ hình thành liên kết của các phân tử có liên kết ion và viết công thức Lewis của các phân tử có liên kết cộng hóa trị.
b) Phân tử M được tạo thành từ 5 nguyên tử của hai nguyên tố Y và R tạo nên (Số hiệu nguyên tử Y nhỏ hơn của R). Tổng số hạt mang điện trong phân tử M là 20.Xác định công thức phân tử M.
Câu 3.
a) Dựa vào cấu tạo nguyên tử, phân tử hãy giải thích:
– ion CO không thể nhận thêm một nguyên tử oxygen để tạo ion CO
trong khi đó ion SO
có thể nhận thêm 1 nguyên tử oxygen để tạo thành ion SO
?
– NO2 có khả năng dimer hóa tạo thành N2O4.
– SO2 tan trong nước nhiều hơn CO2.
b) Cân bằng các phương trình phản ứng sau theo phương pháp thăng bằng electron.
(1) H2O2 + KMnO4 + H2SO4 → MnSO4 + O2 + K2SO4 + H2O.
(2) Cr2S3 + Mn(NO3)2 + K2CO3 → K2CrO4 + K2SO4 + K2MnO4 + NO + CO2
Câu 4.
a) Ở điều kiện chuẩn, 2 mol aluminium (nhôm) tác dụng vừa đủ với khí chlorine tạo muối aluminium chloride và giải phóng một lượng nhiệt 1390,81 kJ.
– Biến thiên enthalpy chuẩn của phản ứng bằng bao nhiêu? Phản ứng trên thu nhiệt hay toả nhiệt?
– Tính lượng nhiệt được giải phóng khi 10 gam A1C13 được tạo thành.
b) Cho phương trình nhiệt hoá học sau:
4NH3(g) + 3O2(g) ” 2N2(g) + 6H2O(g)
Tính biến thiên Enthalpy chuẩn của phản ứng dựa vào năng lượng liên kết của các nguyên tử:
Eb(N-H) = 391(kJ/mol); Eb(O=O) = 498(kJ/mol); Eb(N-H) = 391(kJ/mol); Eb(NºN) = 945(kJ/mol); Eb(O-H) = 467(kJ/mol).
Câu 5.
a) Tốc độ phản ứng sau chịu ảnh hưởng của yếu tố nào?
– Than củi đang cháy, dùng quạt thổi thêm không khí vào, sự cháy diễn ra mạnh hơn.
– Phản ứng oxi hóa SO2 thành SO3 diễn ra nhanh hơn khi có mặt xúc tác V2O5.
– Aluminium dạng bột phản ứng với dung dịch hydrochloric acid nhanh hơn so với aluminium dạng lá.
– Để thực phẩm trong tủ lạnh giúp cho thực phẩm được tươi lâu hơn.
b) Khi để ở nhiệt độ 30 oC, một quả táo bị hư sau 3 ngày. Khi được bảo quản ở 0 oC (trong tủ lạnh), quả táo bị hư sau 24 ngày. Nếu bảo quản ở 20 oC, quả táo bị hư sau bao nhiêu ngày
——- Hết ———
| SỞ GIÁO DỤC VÀ ĐÀO TẠO THÁI BÌNH | KỲ THI CHỌN HỌC SINH GIỎI LỚP 10 THPT NĂM HỌC 2023-2024 ĐÁP ÁN ĐỀ MINH HỌA MÔN HÓA HỌC |
Phần I.
(Mỗi câu trả lời đúng thí sinh được 0,4 điểm).
| Câu | Đáp án | Câu | Đáp án |
| 1 | B | 11 | B |
| 2 | B | 12 | B |
| 3 | B | 13 | C |
| 4 | D | 14 | D |
| 5 | C | 15 | A |
| 6 | A | ||
| 7 | B | ||
| 8 | C | ||
| 9 | A | ||
| 10 | B |
Phần II: Đáp án
Điểm tối đa của 01 câu hỏi là 1,0 điểm
– Thí sinh chỉ lựa chọn chính xác 01 ý trong 1 câu hỏi được 0,1 điểm.
– Thí sinh chỉ lựa chọn chính xác 02 ý trong 1 câu hỏi được 0,25 điểm.
– Thí sinh chỉ lựa chọn chính xác 03 ý trong 1 câu hỏi được 0,5 điểm.
– Thí sinh chỉ lựa chọn chính xác 04 ý trong 1 câu hỏi được 1 điểm.
| Câu | Lệnh hỏi | Đáp án (Đ/S) | Câu | Lệnh hỏi | Đáp án (Đ/S) |
| 1 | a | Đ | 2 | a | Đ |
| b | S | b | Đ | ||
| c | Đ | c | Đ | ||
| d | Đ | d | Đ | ||
| 3 | a | Đ | 4 | a | Đ |
| b | Đ | b | Đ | ||
| c | S | c | Đ | ||
| d | S | d | Đ |
Phần III:
Câu 1.
a)
| ∆f | 0,25 |
| Áp dụng định luật Hess => – (2) + (5) +(6) => C + O2 ® CO2 (9) => ∆H(7) = – ∆H(2) + ∆H(5) + ∆H(6) = – 393,5kJ Đơn chất có ∆f | 0,25 |
| Áp dụng định luật Hess => – (3) + (5) => C + 0,5O2 + Cl2® COCl2 (10) => ∆H(8) = – ∆H(3) + ∆H(5) = – 223 kJ Đơn chất có ∆f | 0,25 |
| Phản ứng (7): CO(NH2)2 (s) + H2O (g) ® CO2 (g) + 2NH3 (g) Ta thấy: (7) = (1) – (2) + (3) – (4) Áp dụng định luật Hess: ∆H(7) = ∆H(1) – ∆H(2) + ∆H(3) – ∆H(4) => ∆H(7) = -12,23 kJ | 0,25 |
b)
| Trong công thức cấu tạo của ethanol | 0.5 0.5 |
Câu 2.
a)
hoặc | 0,25 |
| 2x3e | 0,25 |
| 0,5 |
b)
| – Đặt công thức phân tử M là YaRb (ZY < ZX) – Gọi số proton và electron của Y và R lần lượt là PY, EY, PR, ER – Ta có: a + b = 5 (1) – Tổng số hạt mang điện trong phân tử M là a(PY + EY) + b(PR + ER) = 20 Mà PY = EY; PR = ER | 0,25 |
| Từ (1) và (2), ta có – Số proton trung bình của Y và R là | 0,25 |
| 0, 5 |
Câu 3.
a)
| Nộ dung | Điểm |
| Cấu tạo của CO | 0,25 0,25 |
| – Do N trong NO2 có 1 electron độc thân nên 2 phân tử NO2 kết hợp với nhau tạo N2O4. | 0,25 |
| – Nước là dung môi phân cực Phân tử CO2 (dạng thẳng) không phân cực (có momen lưỡng cực bằng 0). Phân tử SO2 (dạng gấp khúc) phân cực (có momen lưỡng cực > 0) | 0,25 |
b)
| Nộ dung | Điểm |
| (1) | 0,25 0,25 |
| (2) | 0,25 0,25 |
Câu 4.
a)
| HƯỚNG DẪN CHẤM | ĐIỂM |
| 0,5 | |
| Nhiệt lượng giải phóng bằng: | 0,5 |
b)
| HƯỚNG DẪN CHẤM | ĐIỂM |
| Biến thiên Enthalpy của phản ứng tính theo Eb: 4NH3(g) + 3O2(g) ” 2N2(g) + 6H2O(g) | 0,5 0,5 |
Câu 5.
a)
| – Ảnh hưởng bởi yếu tố nồng độ. Than cháy luôn cần oxygen để duy trì sự cháy, khi thổi không khí vào, làm tăn nồng độ oxygen, than cháy mạnh hơn. | 0,25 |
| – Ảnh hưởng bởi yếu tố xúc tác. Xúc tác giúp phản ứng dễ xảy ra hơn. | 0,25 |
| – Ảnh hưởng yếu tố bề mặt tiếp xúc. Aluminum dạng bột có bề mặt tiếp xúc lớn hơn dạng lá, phản ứng xảy ra nhanh hơn. | 0,25 |
| – Ảnh hưởng bởi yếu tố nhiệt độ. Quá trình bảo quản thực phẩm trong tủ lạnh, nhiệt độ thấp hơn nhiệt độ ngoài không khí → hạn chế vi khuẩn phá hủy thức ăn. | 0.25 |
b)
| HƯỚNG DẪN CHẤM | ĐIỂM |
| 0,5 | |
| 0,5 |
O2 Education gửi các thầy cô link download đề thi
Các thầy cô có thể xem thêm nhiều đề thi hsg của các tỉnh khác tại
Tổng hợp đề thi hsg lớp 10 môn hoá học
Đề thi hsg môn hóa lớp 10 cụm trường Ứng Hòa Mỹ Đức năm 2023 2024
1
| SỞ GIÁO DỤC VÀ ĐÀO TẠO HÀ NỘI CỤM TRƯỜNG THPT ỨNG HÒA – MỸ ĐỨC | ĐỀ THI OLYMPIC CÁC MÔN VĂN HÓA LỚP 10, 11 NĂM HỌC 2023 – 2024 Môn thi: Hoá học – Lớp: 10 (Thời gian làm bài: 150 phút, không kể thời gian giao đề) |
– Nguyên tử khối của: H=1; C=12; O= 16; Na=23; Mg=24; Al=27; S=32; Cl=35,5;
K=39; Ca=40; Cr = 52; Mn=55; Fe = 56; Cu=64; Zn=65; Br=80; I=127; Ba=137.
– Số hiệu nguyên tử của: 1H, 2He, 3Li, 4Be, 5B, 6C, 7N, 8O, 9F, 10Ne, 11Na, 12Mg, 13Al,
14Si, 15P, 16S, 17Cl, 19K, 20Ca,24Cr, 26Fe, 29Cu, 31Ga, 35Br, 53I, 54Xe.
Câu 1 (4,5 điểm).
1.1. Nguyên tử nguyên tố X có cấu hình electron lớp ngoài cùng là 4s2 và X có 8
electron hoá trị. Ion Y2- có cấu hình electron lớp ngoài cùng là 3s23p6. Nguyên tố R ở chu
kỳ 3 và không có electron độc thân.
a. Viết cấu hình electron của X, Y, R. Xác định vị trí của X, Y, R trong bảng tuần
hoàn? Giải thích.
b. Dựa vào cấu hình electron cho biết các nguyên tố X, Y, R trên là kim loại, phi kim
hay khí hiếm? vì sao?
c. Viết cấu hình electron của ion X2+ và X3+. Ion nào có cấu hình electron bền hơn?
Vì sao?
1.2. Trong tự nhi n, carbon c 2 đ ng vị bền 126Cv 13 6C. Nguy n tử khối trung b nh
của carbon l 12,011. Phần tr m về khối lượng của đ ng vị 13 6Ctrong hợp chất C3H8O2 l
bao nhiêu? (coi nguy n tử khối của H = 1, O = 16)
1.3. Almelec l hợp kim của aluminium với một lượng nhỏ magnesium v silicon
(98,8% aluminium; 0,7% magnesium v 0,5% silicon). Almelec được sử dụng l m dây dẫn
điện cao thế do nhẹ, dẫn nhiệt tốt v bền. Dựa v o số hiệu nguy n tử của nguy n tố h a học
ở tr n, Em hãy:
a. Sắp xếp theo thứ tự t ng dần về bán kính nguy n tử của các nguy n tố h a học
trong almelec.
b. Cho biết thứ tự giảm dần về độ âm điện của các nguy n tố h a học c trong
almelec.
c. Biết aluminium oxide v aluminium hydroxide l chất lưỡng tính. Viết phương
tr nh minh hoạ cho tính chất lưỡng tính của 2 chất tr n.
Câu 2 (4 điểm).
2.1. M v R l các nguy n tố thuộc nh m A, c thể tạo với hydrogen các hợp chất MH
v RH. Gọi X v Y lần lượt l hidroxide ứng với h a trị cao nhất của M v R. Trong Y, R
chiếm 35,323% khối lượng. Để trung hòa ho n to n 50 gam dung dịch 16,8% X cần 150 ml
dung dịch Y 1M.
a. Xác định các nguy n tố M v R.
b. Viết công thức lewis của X, Y
2.2. X và Y l hai nguy n tố thuộc hai nh m A kế tiếp nhau trong bảng tuần ho n, ở
trạng thái đơn chất X và Y phản ứng được với nhau. Tổng số proton trong hạt nhân nguy n
tử của X và Y l 23. Biết rằng X đứng sau Y trong bảng tuần ho n. Xác định X và Y?
ĐỀ CHÍNH THỨC
2
2.3. Sulfur (S) l chất rắn, xốp, m u v ng nhạt ở điều kiện thường. Sulfur v hợp
chất của n được sử dụng trong acquy, bột giặt, thuốc diệt nấm; do dễ cháy n n S còn được
dụng để sản xuất các loại di m, thuốc súng, pháo hoa,.. Trong bảng tuần ho n, nguy n tố S
nằm ở chu k 3, nh m VIA.
a. Nguy n tử của nguy n tố S c bao nhi u electron thuộc lớp ngo i cùng? Các electron lớp
ngo i cùng thuộc những phân lớp n o?
b. Viết công thức của oxide v hydroxide ứng với hoá trị cao nhất của sulfur?
c. hydroxide ứng với hoá trị cao nhất của sulfur c tính chất hoá học g ? Viết phương trình
minh hoạ tính chất đ .
Câu 3 (3,5điểm).
3.1. Cân bằng phản ứng oxi hoá – khử sau theo phương pháp th ng bằng electron?
a. HCl + MnO2 MnCl2 + Cl2 + H2O
b. CuFeS2 + O2 Cu2S + SO2 + Fe2O3
c. NaIOx + SO2 + H2O I2 + Na2SO4 + H2SO4
d. KClO4 + C KCl + CO
3.2. Một số loại máy đo n ng độ c n trong hơi thở dựa tr n phản ứng của ethanol (c n)
(C2H5OH) c trong hơi thở với hợp chất potassium dichromate trong môi trường sulfuric acid
loãng. Phản ứng (chưa được cân bằng) như sau:
C2H5OH + K2Cr2O7 + H2SO4 CH3COOH + Cr2(SO4)3 + K2SO4 + H2O
a. Cân bằng phương tr nh phản ứng tr n bằng phương pháp th ng bằng electron.
b. Một mẫu khí thở của người điều khiển xe máy tham gia giao thông c thể tích 50mL
được thổi v o thiết bị Breathalyzer c chứa 1mL K2Cr2O7 0,05 mg/mL (trong môi trường
H2SO4 50% v n ng độ ion Ag+ 0.25mg/mL, ổn định). Biết rằng phản ứng xảy ra ho n to n.
Hãy cho biết người đ c vi phạm luật giao thông hay không v n u h nh thức xử phạt (nếu
có).
Sử dụng bảng mức độ phạt đối với người điều khiển xe máy vi phạm n ng độ c n để
trả lời câu hỏi tr n.
| Mức độ vi phạm nồng độ cồn | Mức tiền phạt | Hình phạt bổ sung |
| Chưa vượt quá 0,25 mg/1L khí thở. | 2 triệu đ ng đến 3 triệu đ ng. | Tước giấy phép lái xe từ 10-12 tháng. |
| Vượt quá 0,25 mg- 0,4/1L khí thở. | 4 triệu đ ng đến 5 triệu đ ng. | Tước giấy phép lái xe từ 16-18 tháng. |
| Vượt quá 0,4/1L khí thở. | 6 triệu đ ng đến 8 triệu đ ng. | Tước giấy phép lái xe từ 22-24 tháng. |
(trích từ Nghị định 100/ 2019/ NĐ-CP sửa đổi tại Nghị định 123/2021/NĐ-CP)
Câu 4 (4 điểm).
4.1. Cho biết giá trị độ âm điện của một số nguy n tố như bảng dưới đây:
| Nguyên tố | 12Mg | 13Al | 1H | 16S | 17Cl | 😯 | 15P | 9F |
| Độ âm điện | 1,31 | 1,61 | 2,20 | 2,58 | 3,16 | 3,44 | 2,19 | 3,98 |
a. Xác định loại ki n kết trong các phân tử: PCl3, MgCl2, SO3, Al2O3. Hãy viết sơ đ h nh
th nh li n kết của các phân tử c li n kết ion v viết công thức Lewis của các phân tử c
li n kết cộng h a trị.
3
| b. Hãy giải thích v sao H2O v HF c khối lượng mol phân tử, độ d i li n kết tương đương nhưng thiệt độ sôi của H2O cao hơn nhiều so với HF ? | Độ dài liên kết | M | |
| H2O | H – O: 0,96Ao | 18 | 100oC |
| HF | H – F: 0,92Ao | 20 | 19,5oC |
4.2. Hỗn hợp X g m Fe v kim loại M (h a trị n không đổi). Hòa tan ho n to n m
gam X trong dung dịch H2SO4 đặc, n ng, dư được dung dịch A v V lít khí SO2 (sản phẩm
khử duy nhất ở đkc). Hấp thụ hết lượng SO2 tr n bằng 500 ml dung dịch NaOH 0,2M thu
được dung dịch chứa 5,725 gam chất tan.
– Th m v o m gam X một lượng kim loại M gấp đôi lượng kim loại M c trong X,
thu được hỗn hợp Y. Cho Y tan hết trong dung dịch HCl dư thu được 1,921225 lít khí H2
(đkc).
– Th m v o m gam X một lượng Fe bằng lượng Fe c trong X, thu được hỗn hợp Z.
Cho Z tác dụng với dung dịch H2SO4 loãng, dư thu được dung dịch B chứa 5,605 gam muối.
1. Tính V.
2. Xác định kim loại M v tính th nh phần phần tr m khối lượng của hỗn hợp X.
Câu 5 (4 điểm).
5.1. Cho các số liệu về biến thiên enthalpy chuẩn của các quá tr nh chuyển h a sau (ở 298K)
| STT | Phản ứng | (kJ) |
| 1 | H2 (g) + Cl2 (g) 2HCl (g) | -184,6 |
| 2 | CO2 (g) + H2 (g) CO (g) + H2O (g) | 41,13 |
| 3 | COCl2 (g) Cl2 (g) + CO (g) | 12,5 |
| 4 | 2NH3 (g) + COCl2 (g) CO(NH2)2 (s) + 2HCl (g) | -201 |
| 5 | C (s) + 0,5O2 (g) CO (g) | -110,5 |
| 6 | H2 (g) + 0,5O2 (g) H2O (g) | -241,87 |
a. Tính nhiệt tạo th nh chuẩn (∆f của HCl, CO2 và COCl2.
b. Tính biến thi n enthalpy chuẩn của phản ứng sau:
CO(NH2)2 (s) + H2O (g) CO2 (g) + 2NH3 (g)
5.2 Dựa v o số liệu về n ng lượng li n kết, hãy tính biến thi n enthalpy của 2 phản ứng sau:
2H2(g) + O2(g)
o
t
2H2O(g) (1)
C7H16(g) + 11O2(g)
o
t
7CO2(g) + 8H2O(g) (2)
Từ giá trị enthalpy thu được, cho biết H2 hay C7H16 là nhiên liệu hiệu quả hơn cho t n lửa?
Biết trong C7H16 c 6 li n kết C- C v 16 li n kết C-H.
Biết n ng lượng li n kết được cho trong bảng sau:
| Li n kết | Eb(kJ/mol) | Li n kết | Eb(kJ/mol) | Li n kết | Eb(kJ/mol) |
| H-H | 432 | O-H | 467 | C-H | 432 |
| O=O | 498 | C-C | 347 | C=O | 745 |
———-HẾT———-
Cán bộ coi thi không giải thích gì thêm!
Họ và tên thí sinh: ……………………………….. Số báo danh: …………….
Chữ ký giám thị coi thi số 1: Chữ ký giám thị coi thi số 2:
O2 Education gửi các thầy cô link download đề thi
Các thầy cô có thể xem thêm nhiều đề thi hsg của các tỉnh khác tại
Tổng hợp đề thi hsg lớp 10 môn hoá học
Đề thi hsg môn hóa lớp 10 cấp trường Hà Nội năm 2023 2024
| SỞ GIÁO DỤC&ĐÀO TẠO HÀ NỘI TRƯỜNG THPT | ĐỀ THI HỌC SINH GIỎI CẤP TRƯỜNG NĂM HỌC 2023-2024 |
Môn: HÓA HỌC
Khối lớp: 10
Thời gian: 120 phút (không kể thời gian giao đề)
Ngày thi: 17/01/2024
Đề thi gồm 03 trang, 05 câu
Câu 1 (5,0 điểm)
1.1. Magnesium (Mg) là một trong những nguyên tố vi lượng đóng vai trò quan trọng của cơ thể, giúp xương chắc khỏe, tim khỏe mạnh và lượng đường trong máu bình thường. Dựa vào phổ khối lượng của magnesium ở hình dưới đây, hãy trả lời các câu hỏi sau:
a. Magnesium có bao nhiêu đồng vị bền? Cho biết kí hiệu nguyên tử và thành phần phần trăm tương ứng của mỗi đồng vị.
b. Tính nguyên tử khối trung bình của magnesium?
a. Xác định nguyên tố M, X và công thức phân tử MX2.
b. So sánh (có giải thích) bán kính của các nguyên tử và ion: M, M2+, X–.
Câu 2 (5,0 điểm)
2.1. Nguyên tố chlorine có Z = 17, có trong thành phần của nước tẩy trắng, tẩy uế, nhựa PVC…
a. Viết cấu hình electron và xác định vị trí của chlorine trong bảng tuần hoàn các nguyên tố hóa học.
b. Cho biết tính chất hóa học cơ bản của chlorine (kim loại hay phi kim). Viết phương trình hóa học xảy ra (nếu có) khi cho chlorine tác dụng với các chất: hydrogen, iron.
c. Viết công thức oxide cao nhất và hydroxide tương ứng, cho biết chúng có tính acid hay base?
2.2. Cho biết độ âm điên của các nguyên tố sau:
| Nguyên tố | H | N | Al | Cl | F |
| Độ âm điện | 2,20 | 3,04 | 1,61 | 3,16 | 3,98 |
b. So sánh (có giải thích) nhiệt độ sôi của NF3 và NH3; nhiệt độ nóng chảy của AlCl3 và AlF3.
2. 3. Giải thích tại sao ion CO32 – không thể nhận thêm một nguyên tử oxygen để tạo ion CO42 –, trong khi đó ion SO32 – có thể nhận thêm 1 nguyên tử oxygen để tạo thành ion SO42 – ?
Câu 3 (4,0 điểm)
3.1. Cân bằng các phản ứng oxi hoá khử sau đây bằng phương pháp thăng bằng electron, chỉ rõ chất khử, chất oxi hóa, quá trình khử, quá trình oxi hóa?
a. KI + KMnO4 + H2SO4 MnSO4 + I2 + K2SO4 + H2O
b. Fe3O4 + HNO3 ® Fe(NO3)3 + NxOy + H2O
3.2. Sodium peroxide (Na2O2), potassium superoxide (KO2) là những chất oxi hóa mạnh, dễ dạng hấp thụ khí carbon dioxide và giải phóng khí oxygen. Do đó, chúng được sử dụng trong bình lặn hoặc tàu ngầm để hấp thụ khí carbon dioxide và cung cấp khí oxygen cho con người trong hô hấp theo các phản ứng sau:
Na2O2 + CO2 → Na2CO3 + O2↑
KO2 + CO2 → K2CO3 + O2↑
Theo nghiên cứu, khi hô hấp, thể tích khí carbon dioxide một người thải ra xấp xỉ thể tích oxygen hút vào. Cần trộn Na2O2 và KO2 theo tỉ lệ số mol như thế nào để thể tích khí carbon dioxide hấp thụ bằng thể tích khí oxygen sinh ra?
Câu 4 (3,0 điểm)
4.1. Cho các quá trình dưới đây, quá trình nào là thu nhiệt, quá trình nào là tỏa nhiệt? Giải thích?
| a. Quang hợp của cây xanh | Dán miếng dán giữ nhiệt vào bàn chân khi trời lạnh | Luộc chín quả trứng |
4. 2. Cho phương trình nhiệt hoá học:
C2H4(g) + H2(g) C2H6(g)
a. Trong phương trình trên, enthalpy chuẩn của phản ứng có phải enthalpy tạo thành chuẩn của C2H6 không? Vì sao?
b. Vẽ sơ đồ biểu diễn biến thiên enthalpy của phản ứng trên.
c. Hãy tính năng lượng liên kết (Eb) của liên kết C – H trong các chất ở phản ứng trên biết rằng năng lượng liên kết đo ở điều kiện chuẩn của một số liên kết như sau:
| Liên kết | H – H | C – C | C = C | C ≡ C |
| Eb (kJ/mol) | 436 | 347 | 612 | 839 |
Câu 5 (3,0 điểm)
5.1. Xăng và dầu diezel là các loại nhiên liệu lỏng được sử dụng trong các động cơ đốt trong của xe máy, xe ô tô…Khí thải của động cơ đốt trong chứa các chất gây ô nhiễm. Khối lượng (gam) của các chất ô nhiễm khi đốt 1 kg nhiên liệu như sau:
| Nhiên liệu | CO | NOx | SO2 | Các hợp chất hữu cơ không cháy hết | Các chất khác |
| Xăng | 236 | 29 | 0,9 | 25 | 0,6 |
| Diezel | 10 | 59 | 3,8 | 17 | 18,6 |
a. Chất ô nhiễm nào là khí độc gây chết người, là sản phẩm cháy không hoàn toàn của nhiên liệu?
b. Nhiên liệu nào gây ô nhiễm dẫn đến mưa acid nhiều hơn (tính theo 1 kg nhiên liệu)? Giải thích?
c. NO2 được tạo thành khi O2 phản ứng với N2. Viết phương trình phản ứng.
d. Nhiều động cơ sử dụng chất xúc tác để giảm ô nhiễm do khi có mặt chất xúc tác thì CO khử NO2 tạo thành hai khí không độc. Hãy cho biết tên của hai khí này.
5.2. Octane (C8H8) có trong thành phần của xăng.
Cho biết: C (Z = 6); O (Z = 8); S (Z = 16); Cl (Z = 17); Ca (Z = 20).
———-HẾT———-
• Thí sinh KHÔNG được sử dụng tài liệu;
• Cán bộ coi thi KHÔNG giải thích gì thêm.
Họ và tên thí sinh: ………………………………………
Lớp: …………… Số báo danh: …………………
O2 Education gửi các thầy cô link download đề thi
Các thầy cô có thể xem thêm nhiều đề thi hsg của các tỉnh khác tại
Tổng hợp đề thi hsg lớp 10 môn hoá học