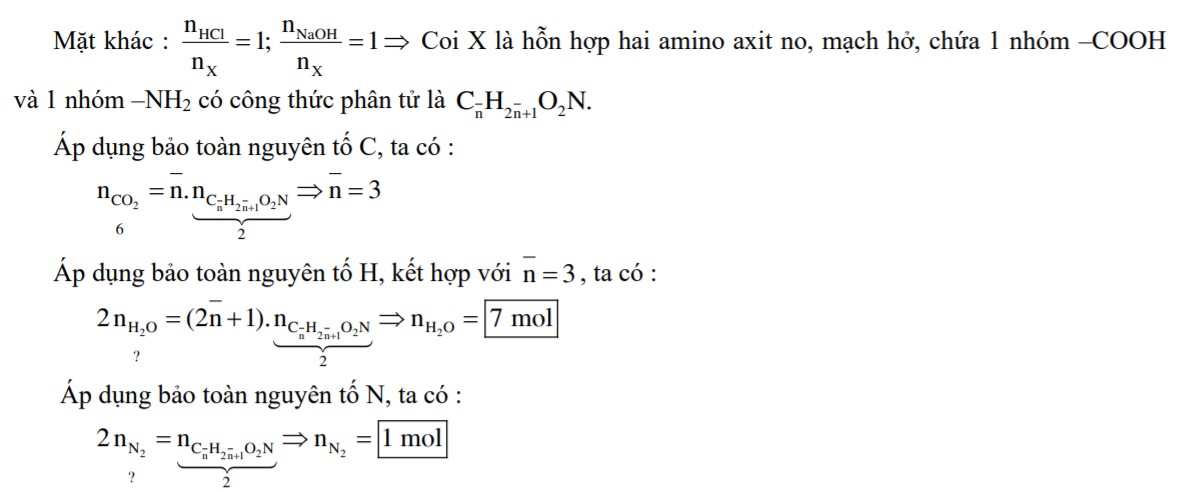Tìm khoảng giới hạn
PHƯƠNG PHÁP 13: TÌM KHOẢNG GIỚI HẠN
I. PHƯƠNG PHÁP TÌM KHOẢNG GIỚI HẠN
1. Nội dung phương pháp tìm khoảng giới hạn
Hiện nay, đang có nhiều hệ thống phân dạng bài tập hóa học : Phân dạng bài tập theo tính chất hóa học của các chất (kim loại tác dụng với dung dịch axit, CO2 tác dụng với dung dịch kiềm, anđehit tác dụng với dung dịch AgNO3/NH3,…); phân dạng bài tập theo loại phản ứng (phản ứng cộng, tách, oxi hóa, trao đổi,…); phân dạng bài tập theo các phương pháp giải nhanh (bảo toàn electron, bảo toàn nguyên tố, bảo toàn khối lượng, bảo toàn điện tích,…);… Mỗi hệ thống phân dạng đều có những ưu điểm và nhược điểm riêng.
Tuy nhiên, nếu căn cứ vào yêu cầu của đề bài thì có thể chia bài tập hóa học thành 2 dạng chính: Tính lượng chất (1); Tìm chất (2). Đối với dạng (1), hướng tư duy là tìm số mol của các chất, từ đó suy ra khối lượng, thể tích (đối với các chất khí), nồng độ mol, nồng độ phần trăm,… Đối với dạng (2), hướng tư duy là tìm khối lượng mol; tìm thành phần cấu tạo nên chất đó;… Với hướng tư duy thông thường như vậy, ta có thể giải quyết được khá nhiều bài tập. Nhưng có một số bài tập, khi mà các giả thiết đã được khai thác triệt để, ta vẫn không thể tìm được kết quả.
Vậy cần phải tìm hướng tư duy giải toán mới. Nếu trước đây, ta chỉ có một hướng tư duy là tìm chính xác các giá trị như số mol, khối lượng, thể tích,… hoặc khối lượng mol của chất mà đề bài yêu cầu, thì bây giờ ta có thể giải bài tập theo một hướng tư duy khác, đó là tìm khoảng giới hạn của các giá trị số mol, khối lượng, thể tích,… hoặc tìm khoảng giới hạn khối lượng mol của chất cần tìm. Từ đó dựa vào đặc điểm của các chất (khối lượng mol, cấu tạo hóa học,…) và có khi là cả đáp án để tìm đáp số.
Phương pháp tìm khoảng giới hạn là phương pháp giải bài tập hóa học dựa vào việc tìm khoảng giới hạn của các giá trị như khối lượng, số mol, thể tích, khối lượng mol của các chất. Để từ đó suy ra giá trị hoặc công thức, tên gọi của chất mà đề bài yêu cầu.
2. Ưu điểm của phương pháp tìm khoảng giới hạn
a. Xét các hướng giải bài tập sau:
Câu 2 – Mã đề 268: Đốt cháy hoàn toàn 2,76 gam hỗn hợp X gồm CxHyCOOH, CxHyCOOCH3, CH3OH thu được 2,688 lít CO2 (đktc) và 1,8 gam H2O. Mặt khác, cho 2,76 gam X phản ứng vừa đủ với 30 ml dung dịch NaOH 1M, thu được 0,96 gam CH3OH. Công thức của CxHyCOOH là
A. C2H5COOH. B. CH3COOH. C. C2H3COOH. D. C3H5COOH.
(Đề thi tuyển sinh Cao đẳng năm 2010)
Hướng dẫn giải
● Cách 1 : Sử dụng phương pháp bảo toàn nguyên tố
Theo giả thiết, ta có :
Đặt gốc CxHy là R.
Số mol O trong X là :
Áp dụng bảo toàn nguyên tố đối với O, ta có :
Áp dụng bảo toàn nguyên tố đối với Na và bảo toàn gốc R–, ta có :
Áp dụng bảo toàn bảo toàn gốc CH3– , ta có :
Từ (1), (2), (3), ta có :
Vậy CxHyCOOH là
● Cách 2 : Sử dụng phương pháp tìm khoảng giới hạn
Giả sử CxHyCOOH, CxHyCOOCH3 là no, đơn chức thì khi đốt cháy sẽ thu được số mol CO2 bằng số mol H2O. Đốt cháy ancol CH3OH thu được số mol H2O lớn hơn số mol CO2. Khi đó tổng số mol H2O sẽ lớn hơn số mol CO2. Trên thực tế, khi đốt cháy X số mol CO2 lớn hơn số mol H2O, chứng tỏ CxHyCOOH, CxHyCOOCH3 phải không no. Suy ra các phương án A, B không thỏa mãn. Phương án đúng chỉ có thể là C hoặc D.
Sơ đồ phản ứng : X + NaOH CH3OH + CxHyCOONa + H2O
Theo bảo toàn khối lượng, ta có :
Mặt khác, áp dụng bảo toàn nguyên tố đối với Na, ta có:
Từ (*) và (**) suy ra:
Vậy CxHyCOOH là
c. Kết luận :
Với cách 1 : Tư duy giải toán theo cách thông thường, đó là tìm chính xác khối lượng của gốc hiđrocacbon CxHy–. Từ đó suy ra cấu tạo của gốc hiđrocacbon và công thức của axit. Với bài tập này, đề bài cho đủ giả thiết để tìm chính xác gốc hiđrocacbon, nhưng phải vận dụng bảo toàn nguyên tố đối với nhiều nguyên tố và nhóm nguyên tố hoặc phải viết phương trình và tính toán theo phương trình phản ứng. Vì vậy, lời giải dài dòng và mất nhiều thời gian.
Với cách 2 : Tư duy theo hướng tìm khoảng giới hạn khối lượng mol của gốc hiđrocacbon. Với cách này, việc tính toán trở nên đơn giản hơn nhiều. Mặc dù không tìm được chính xác khối lượng của gốc hiđrocacbon, nhưng với và CxHy là gốc không no thì nó chỉ có thể là hoặc . Do sự lựa chọn đã giới hạn chỉ còn C hoặc D nên rất dễ dàng tìm được gốc hiđrocacbon là .
3. Phạm vi áp dụng :
Phương pháp tìm khoảng giới hạn chủ yếu được dùng để giải quyết các bài tập mà việc tính toán trực tiếp ra kết quả gặp khó khăn, do sự giới hạn của giả thiết.
Một số dạng bài tập sử dụng phương pháp khoảng giới hạn là :
+ Tính lượng chất trong phản ứng.
+ Tìm kim loại, tìm công thức của hợp chất hữu cơ.
II. PHÂN DẠNG BÀI TẬP VÀ CÁC VÍ DỤ MINH HỌA
Phương pháp giải
– Bước 1 : Lập sơ đồ phản ứng biểu diễn quá trình chuyển hóa giữa các chất, để thấy rõ bản chất hóa học của bài toán.
– Bước 2 : Nhận dạng nhanh phương pháp giải bài tập : Khi gặp những bài tập mà đề bài không cung cấp đủ giả thiết để tìm được kết quả chính xác hoặc có thể tìm được kết quả chính xác nhưng phải làm dài dòng, mất nhiều thời gian thì ta nên sử dụng phương pháp tìm khoảng giới hạn.
– Bước 3 : Căn cứ vào giả thiết để lựa chọn giá trị trong phương pháp tìm khoảng giới hạn. Nếu là bài tập tính lượng chất thì giá trị đó thường là số mol, khối lượng, thể tích,… Nếu là bài tập tìm chất thì giá trị thường là khối lượng mol.
– Bước 4 : Dựa vào giả thiết để thiết lập khoảng giới hạn đối với các giá trị số mol, khối lượng, thể tích,… hoặc khối lượng mol của chất cần tìm. Từ đó dựa vào cấu tạo, tính chất của chất và các phương án A, B, C, D đề cho để tìm ra kết quả của bài toán.
► Các ví dụ minh họa ◄
1. Tính lượng chất trong phản ứng
Trong đề thi tuyển sinh Đại học và Cao đẳng, mỗi năm đều có những bài tập khó để phân loại học sinh. Nếu tính toán để tìm ra kết quả chính xác thì sẽ mất nhiều thời gian. Ta có thể giải những bài tập này nhanh hơn bằng cách sử dụng phương pháp tìm khoảng giới hạn kết hợp với các đáp án đề cho. Các ví dụ …. sẽ chứng minh điều đó.
Ví dụ 1: Hỗn hợp X gồm 3,92 gam Fe, 16 gam Fe2O3 và m gam Al. Nung X ở nhiệt độ cao trong điều kiện không có không khí, thu được hỗn hợp chất rắn Y. Chia Y thành hai phần bằng nhau. Phần một tác dụng với dung dịch H2SO4 loãng (dư), thu được 4a mol khí H2. Phần hai phản ứng với dung dịch NaOH dư, thu được a mol khí H2. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của m là
A. 5,40. B. 3,51. C. 7,02. D. 4,05.
(Đề thi tuyển sinh Đại học khối A năm 2013)
Hướng dẫn giải
● Cách 1: Sử dụng định luật bảo toàn nguyên tố, bảo toàn electron
Sau phản ứng nhiệt nhôm, hỗn hợp chất rắn Y thu được phản ứng với NaOH tạo ra khí, chứng tỏ Al dư, Fe2O3 đã phản ứng hết.
Áp dụng bảo toàn nguyên tố Fe, ta có :
Áp dụng bảo toàn electron trong phản ứng nhiệt nhôm, ta có :
Theo giả thiết, suy ra : Khi cho Y phản ứng với dụng dịch H2SO4 loãng dư, thu được 8a mol H2;
khi cho Y tác dụng với dung dịch NaOH dư, thu được 2a mol khí H2.
Áp dụng bảo toàn electron, ta có :
● Cách 2: Sử dụng phương pháp tìm khoảng giới hạn kết hợp với các đáp án
Theo bảo toàn electron, ta có :
Vì sau phản ứng nhiệt nhôm, hỗn hợp thu được có khả năng phản ứng với NaOH tạo khí H2, chứng tỏ Al dư.
Suy ra :
Nếu đề cho các đáp án nhiễu tốt hơn thì ta phải làm theo cách 1.
Ví dụ 2: Cho hỗn hợp X gồm 0,01 mol Al và a mol Fe vào dung dịch AgNO3 đến khi phản ứng hoàn toàn, thu được m gam chất rắn Y và dung dịch Z chứa 3 cation kim loại. Cho Z phản ứng với dung dịch NaOH dư trong điều kiện không có không khí, thu được 1,97 gam kết tủa T. Nung T trong không khí đến khối lượng không đổi, thu được 1,6 gam chất rắn chỉ chứa một chất duy nhất. Giá trị của m là
A. 8,64. B. 3,24 . C. 6,48. D. 9,72.
(Đề thi tuyển sinh Đại học khối A năm 2013)
Hướng dẫn giải
● Cách 1 : Sử dụng bảo toàn nguyên tố Fe, bảo toàn electron
Bản chất phản ứng :
Al + Ag+ Al3+ + Ag (1)
Fe + Ag+ Fe2+ + Ag (2)
Nếu Ag+ còn dư thì :
Fe2+ + Ag+ Fe3+ + Ag (3)
Theo giả thiết, dung dịch Z chứa 3 loại cation kim loại nên có hai trường hợp :
+ Các cation kim loại là Al3+, Fe2+, Fe3+.
+ Các cation kim loại là Al3+, Fe3+, Ag+.
Mặt khác, khi cho Z tác dụng với dung dịch NaOH dư trong điều kiện không có không khí, thu được kết tủa T. Nung T trong không khí đến khối lượng không đổi được 1,6 gam chất rắn duy nhất. Nên suy ra dung dịch Z chứa các cation kim loại là Al3+, Fe2+, Fe3+ ; 1,6 gam chất rắn là Fe2O3; 1,97 gam kết tủa T là Fe(OH)2 và Fe(OH)3.
Theo giả thiết, ta có :
Như vậy, đã có 0,01 mol Fe bị oxi hóa thành Fe2+ và 0,01 mol Fe bị oxi hóa thành Fe3+.
Áp dụng bảo toàn electron, ta có :
● Cách 2 : Sử dụng phương pháp tìm khoảng giới hạn
Vì 1,6 gam chất rắn chỉ chứa một chất duy nhất nên đó là Fe2O3. Dung dịch Z chứa 3 loại cation là Al3+, Fe2+, Fe3+. Vậy chất rắn Y chỉ có Ag.
Theo bảo toàn nguyên tố Fe, ta có :
Áp dụng bảo toàn electron, ta có :
O2 Education gửi các thầy cô link download file pdf đầy đủ
Xem thêm