Đề thi giữa học kì 2 môn hóa lớp 10
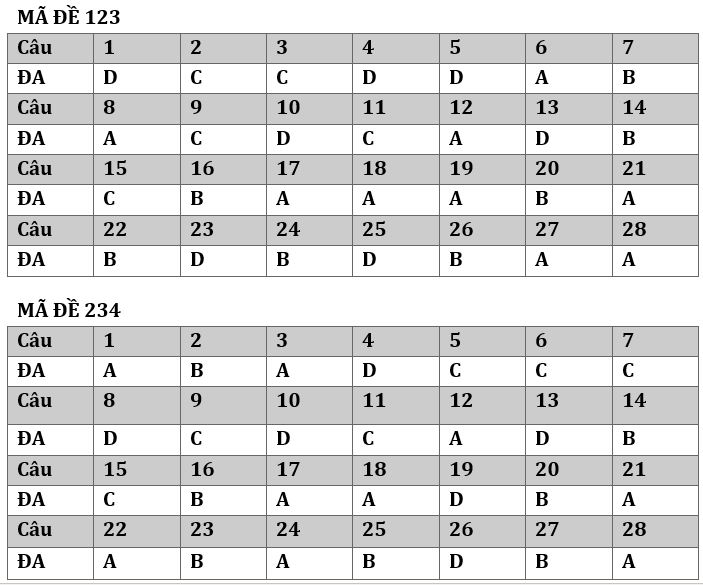
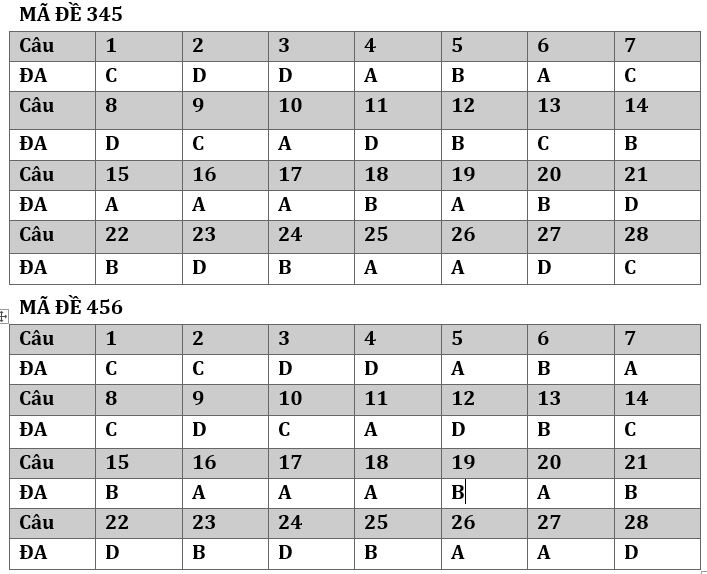

I.Trắc nghiệm: (gồm 28 câu )
Câu 1. Dấu hiệu để ta nhận biết một phản ứng oxi hóa khử là
A. phản ứng có sự thay đổi trạng thái của chất phản ứng.
B. phản ứng có xuất hiện chất khí là chất sản phẩm.
C. phản ứng có sự xuất hiện của chất kết tủa.
D. phản ứng có sự thay đổi số oxi hóa của một nguyên tố.
Câu 2. Phát biểu nào sau đây là chính xác?
A. Sự oxi hóa là sự làm giảm số oxi hóa của một nguyên tố.
B. Sự khử là sự làm tăng số oxi hóa của một nguyên tố.
C. Chất oxi hóa là chất chứa nguyên tố có số oxi hóa giảm sau khi xảy ra phản ứng oxi hóa – khử.
D. Chất khử là chất chứa nguyên tố có số oxi hóa giảm sau khi xảy ra phản ứng oxi hóa – khử.
Câu 3. Phát biểu nào sau đây là đúng về phản ứng kích nổ hỗn hợp nhiên liệu của tàu con thoi:
A. C3H8 là chất khử, O2 là chất oxi hóa. B. C4H8 là chất oxi hóa, O2 là chất khử.
C. H2 là chất khử, O2 là chất oxi hóa. D. C3H8 là chất khử, H2 là chất oxi hóa.
Câu 4. Cho phản ứng hóa học: Ca +Cl2 → CaCl2. Kết luận nào sau đây đúng?
A. Mỗi nguyên tử Ca nhận 2 electron. B. Mỗi nguyên tử Cl nhận 2 electron.
C. Mỗi phân tử Cl nhường 2 electron. D. Mỗi nguyên tử Ca nhường 2 electron.
Câu 5. Trong các phản ứng sau, phản ứng nào không phải là phản ứng oxi hóa – khử:
A. Fe + 2HCl → FeCl2 + H2. B. Zn + CuSO4 → ZnSO4 + Cu.
C. CH4 + Cl2 → CH3Cl + HCl. D. BaCl2 + H2SO4 → BaSO4 + 2HCl.
Trang 1 – Mã Đề 123
Câu 6. Số oxi hóa của S trong các chất: S, SO3, H2S lần lượt là
A.0;+6; -2. B. 0, +6, +2 C. 0; +4; -2. D. 0; +4; +2.
Câu 7. Trongphản ứng oxi hóa-khử, chất khử là chất
A. nhận electron. B. nhường electron
C. nhường proton D. nhận proton
Câu 8. Trong phản ứng hóa học 2K + 2H2O → 2 KOH + H2, chất khử là
A.K B.H2O C.KOH D.H2
Câu 9. Cho phản ứng hóa học: Cl2 + 2NaBr → 2NaCl + Br2 xảy ra quá trình khử chất nào
A. NaCl B.Br2 C.Cl2 D.NaBr
Câu 10. Cho kim loại Zn phản ứng với dung dịch CuSO4. Vai trò của các chất phản ứng:
A. Zn là chất khử. B. CuSO4 là môi trường.
C. CuSO4 là chất oxi hóa. D. Cả A và C
Câu 11. Xét phản ứng SO2 + Br2 + 2H2O → 2HBr + H2SO4, Trong phản ứng này vai trò của SO2 là:
A. Chất oxi hóa. B. Vừa là chất oxi hoá vừa là chất tạo môi trường.
C. Chất khử. D. Vừa là chất khử vừa là chất tạo môi trường.
Câu 12. Quá trình oxi hoá là
A. quá trình cho electron. B. quá trình nhận electron.
C. quá trình tăng electron. D. quá trình tăng số oxy hoá.
Câu 13. Trong phản ứng hóa học: CaCO3 → CaO + CO2, nguyên tố cacbon
A. chỉ bị oxi hóa. B. chỉ bị khử.
C. vừa bị oxi hóa, vừa bị khử. D. không bị oxi hóa, cũng không bị khử.
Câu 14. Chất nào sau đây trong các phản ứng chỉ đóng vai trò là chất oxi hóa?
A. S. B. F2. C. Cl2. D. N2.
Câu 15. Trong phản ứng Cl2 + H2O → HCl + HClO, Cl2 là
A. chất oxi hóa. B. chất khử.
C. vừa là chất khử, vừa là chất oxi hóa. D. chất bị oxi hóa.
Câu 16. Chọn phát biểu sai.
A. Sự oxi hóa là quá trình chất khử cho electron.
B. Trong các hợp chất số oxi hóa hydrogen luôn là -1.
C. Cacbon có nhiều mức oxi hóa (âm hoặc dương) khác nhau.
D. Chất oxi hóa gặp chất khử chưa chắc đã xảy ra phản ứng.
Câu 17. Đơn vị của biến thiên enthalpy của phản ứng theo năng lượng liên kết là?
A kJ; B. kJ/mol; C. mol/kJ; D. kcal/mol.
Câu 18. Điều kiện để xảy ra phản ứng thu nhiệt (t= 25oC)?
A. tHo298K
0. B.
tHo298K
0. C.
tHo298K
0. D.
tHo298K
0.
Trang 2 – Mã Đề 123
Câu 19. Phản ứng tỏa nhiệt là gì?
A. Là phản ứng phóng năng lượng dạng nhiệt.
B. Là phản ứng hấp thụ năng lượng dạng nhiệt.
C. Là phản ứng hấp thụ ion dưới dạng nhiệt.
D. Là phản ứng hấp thụ ion dưới dạng nhiệt.
Câu 20. Cho các phản ứng sau:
(1) C(s) + O2(g) →CO2(g) = -393,5 kJ.
(2) 2Al(s) + 3/2O2(g) →Al2O3(s) = -1675,7 kJ.
(3) CH4(g) + 2O2(g) →CO2(g) + 2H2O(l) = -890,36 kJ.
(4) C2H2(g) + 5/2O2(g) →2CO2(g) + H2O (l) = -1299,58 kJ.
Trong các phản ứng trên, phản ứng nào tỏa nhiều nhiệt nhất?
A. (1). B. (2). C. (3). D. (4).
Câu 21. Biến thiên enthalpy của một phản ứng được ghi ở sơ đồ dưới đây. Kết luận nào sau đây là đúng?
A. Phản ứng tỏa nhiệt.
B. Năng lượng chất tham gia phản ứng nhỏ hơn năng lượng sản phẩm.
C. Biến thiên enthalpy của phản ứng là a kJ/mol.
D. Phản ứng thu nhiệt.
Câu 22. Biến thiên enthalpy chuẩn được xác định ở nhiệt độ nào?
A. 0oC; B. 25oC; C. 40oC; D. 100o
Câu 23. Công thức tính biến thiên enthalpy của phản ứng theo năng lượng liên kết đúng là?
A. =2.∑
(sp)−∑
(cđ).
B. =∑
(cđ)−2.∑
(sp).
C. =2.∑Eb(sp)−∑Eb(cđ).
D. =∑Eb(cđ)−∑Eb(sp).
Câu 24. Đâu là phản ứng tỏa nhiệt trong các ví dụ sau?
A. Nước bay hơi
B. Nước đóng băng.
C. Qúa trình quang hợp.
D. Phản ứng thủy phân.
Trang 3 – Mã Đề 123
Câu 25. Biến thiên enthalpy phụ thuộc vào các yếu tố nào?
A. Điều kiện xảy ra phản ứng. B. Trạng thái vật lý của các chất.
C. Số lượng chất tham gia. D. Cả A và B.
Câu 26. Ý nghĩa của enthapy:
A. Xác định hiệu ứng nhiệt phản ứng trong quá trình đẳng áp.
B. Xác định hiệu ứng nhiệt phản ứng trong quá trình đẳng áp, đẳng nhiệt.
C. Xác định hiệu ứng nhiệt phản ứng trong quá trình đẳng nhiệt.
D. Xác định hiệu ứng nhiệt phản ứng trong quá trình phản ứng.
Câu 27. Biến thiên enthalpy của phản ứng nào sau đây có giá trị âm?
A. Phản ứng tỏa nhiệt. B. Phản ứng thu nhiệt.
C. Phản ứng oxi hóa – khử. D. Phản ứng phân hủy.
Câu 28. Cho phản ứng: NH3 (g) + HCl (g) ⟶ NH4Cl (s)
Biết (NH4Cl(s))= − 314,4 kJ/mol;
(HCl(g)) = − 92,31 kJ/mol;
(NH3(g)) = − 45,9 kJ/mol. Biến thiên enthalpy chuẩn của phản ứng tính là
A. – 176,19 kJ; B. – 314,4 kJ; C. – 452,61 kJ; D. 176,2 kJ;
II. Tự luận
Câu 1: Cân bằng phản ứng hóa học bằng phương pháp thăng bằng electron (1,5 điểm)
a, NH3 + O2 -> H2O + NO
b,Cl2 + NaOH -> NaCl + NaClO + H2O
c, C4H10 + O2 → CO2 + H2O
Câu 2. a,Tính biến thiên enthalpy của phản ứng theo nhiệt tạo thành khi đốt cháy hoàn toàn 1 mol ethane (C2H6).và cho biết phản ứng tỏa nhiệt hay thu nhiệt? vì sao?
C2H6(g) + 7/2O2(g) →2CO2(g) + 3H2O(l)
Biết: (C2H6) = -84,0 kJ mol-1;
(CO2) = -393,5 kJ mol-1;
(H2O) = -285,8 kJ mol-1.
b, Dựa vào năng lượng liên kết, tính . của phản ứng sau:
F2(g) + H2O(g) →2HF(g) + 1/2O2(g).
Biết năng lượng liên kết: EF-F = 159 kJ mol-1; EO-H = 464 kJ mol-1; EH-F = 565 kJ mol-1;
E=498 kJ mol-1.
O2 Education gửi các thầy cô link download đề thi
Mời các thầy cô và các em xem thêm các đề thi giữa học kì 2 môn hóa của cả 3 khối 10 11 12 tại
Hoặc xem thêm các tài liệu khác của môn hóa
Leave a Reply