Đề thi hsg lớp 12 môn hóa tỉnh Hải Dương năm 2017

https://bloghoahoc.com – Chuyên trang đề thi thử Hóa Trang 1/5
https://bloghoahoc.com – Chuyên trang đề thi thử Hóa Trang 2/5
https://bloghoahoc.com – Chuyên trang đề thi thử Hóa Trang 3/5
| SỞ GIÁO DỤC VÀ ĐÀO TẠO HẢI DƯƠNG |
HƯỚNG DẪN CHẤM ĐỀ THI CHỌN HSG TỈNH LỚP 12 NĂM HỌC 2016 – 2017 MÔN THI: HÓA HỌC |
||
| Câu | ý | Nội dung | Điểm |
| 1 | 1 (1,0 điểm) |
* Lấy mỗi bình một ít dung dịch làm mẫu thử và đánh số thứ tự. Nhỏ rất từ từ từng giọt dd HCl đến dư vào từng mẫu thử và quan sát thấy. – Mẫu thử có khí thoát ra ngay là (NaHCO3 và Na2SO4). (I) HCl + NaHCO3 NaCl + CO2 + H2O (1) – Mẫu thử không hiện tượng gì là (NaCl và Na2SO4) (II) – Mẫu thử ban đầu không thấy có khí thoát ra và sau một thời gian mới thấy sủi bọt khí không màu là (NaHCO3 và Na2CO3) và (Na2CO3 và Na2SO4) (III) HCl + Na2CO3 NaHCO3 + NaCl (2) Sau đó HCl + NaHCO3 NaCl + CO2 + H2O (3) * Nhỏ dd BaCl2 vào 2 hai dung dịch thu được sau phản ứng của nhóm (III), thấy: – Dung dịch nào phản ứng làm xuất hiện kết tủa trắng không tan là BaSO4 => dung dịch ban đầu có Na2SO4 và đó là dung dịch ban đầu chứa (Na2CO3 và Na2SO4) Na2SO4 + BaCl2 BaSO4 + 2NaCl (4) – Dung dịch còn lại không hiện tượng và dung dịch ban đầu là (NaHCO3 và Na2CO3) |
0,25 0,25 0,25 0,25 |
| 2 (1,0 điểm) |
TN1: Miếng Na kim loại chạy vo tròn trên mặt nước, phản ứng mãnh liệt, tỏa nhiều nhiệt, có kết tủa xanh lam xuất hiện. 2Na + 2H2O 2NaOH + H2 (1) 2NaOH + CuSO4 Cu(OH)2+ Na2SO4 (2) TN2: Lọ dung dịch xuất hiện vẩn đục màu vàng 2H2S + O2 2S+ 2H2O TN3: – Trước khi đun, các dung dịch tan vào nhau tạo thành dung dịch đồng nhất. – Đun sau vài phút thấy có hơi mùi chuối chín thoát ra, xuất hiện 2 lớp chất lỏng phân biệt. CH3COOH+(CH3)2CHCH2CH2OH CH3COOCH2CH2CH(CH3)3+H2O (mùi chuối chín, không tan trong nước) – Làm lạnh rồi rót thêm ít dung dịch NaCl bão hoà vào thấy hiện tượng phân lớp chất lỏng rõ ràng hơn. |
0,25 0,25 0,25 0,25 |
|
| 1 (1,0 điểm) |
Các chất tìm được là X: CHCH; Y: CH3CHO; Z: CH3-CH2-OH; T: CH3-COOH; G: CH3COONa (1) CaC2 + 2H2O Ca(OH)2 + CHCH (2) CHCH + H2O CH3-CHO (3) CH3-CHO + H2 C2H5OH (4) C2H5OH + O2 CH3COOH + H2O (5) CH3COOH + NaOH CH3COONa + H2O (6) CH3COONa + NaOH Na2CO3 + CH4 (7) 2CH4 CHCH + 3H2 (8) 2CH3CHO + O2 2CH3COOH |
0,25 0,25 0,25 0,25 |
o
H SO ,t 2 4dac
Hg O S 4 ,
Ni to
0
mengiam C ,30
0
CaO t ,
1500 0 C,LLN
2
Mn
https://bloghoahoc.com – Chuyên trang đề thi thử Hóa Trang 4/5
| 2 | 2 (1,0 điểm) |
*Tìm A, B: A, B tác dụng với NaOH theo tỉ lệ mol 1:2 tạo ra 1 muối và một ancol → A, B là este 2 chức. Đốt cháy muối do A tạo ra trong sản phẩm không có nước muối (COONa)2 A: H3COOC – COOCH3; B là: HCOOCH2 – CH2OOCH H3COOC – COOCH3 + 2NaOH→ NaOOC – COONa + 2CH3OH (1) HCOOCH2 – CH2OOCH + 2NaOH → 2HCOONa + C2H4(OH)2 (2) * Tìm C, D: C, D tác dụng với NaOH theo tỉ lệ mol 1:2 tạo ra một muối, 1 ancol và nước → C, D có chứa chức este và chức axit Đốt cháy muối do C tạo ra trong sản phẩm không có nước muối (COONa)2 C: HOOC – COOC2H5; D là: HOOC – CH2 – COOCH3 HOOC-COOC2H5 + 2NaOH → NaOOC-COONa + C2H5OH + H2O (3) HOOC-CH2-COOCH3 + 2NaOH→NaOOC-CH2–COONa +CH3OH +H2O (4) |
0,25 0,25 0,25 0,25 |
| 3 | 1 (1,0 điểm) |
* Gọi ; Khi A tác dụng với CO thì: nO (pư) = = nCO (pư). Xét 2 trường hợp: TH1: dung dịch C chứa Fe(NO3)3 + HNO3 (có thể dư) Bảo toàn e ta có: 1x + 2nCO = 3nNO x = 0,02 y = 0,07455 mol loại TH2: HNO3 hết, dung dịch C chứa Fe(NO3)3 hoặc Fe(NO3)2 hoặc cả hai muối – Bảo toàn H – Bảo toàn oxi cho toàn quá trình 4x + 3y = 0,125 + 0,63 + 0,09 + 0,345 -0,693 = 0,29 4x + 3y = 0,29 (*) Theo tổng khối lượng A bài cho: 232x + 160y = 16,568 (**) Từ (*) và (**) x = 0,059; y = 0,018 * Gọi số mol muối Fe(NO3)3 và Fe(NO3)2 lần lượt là a,b (a,b≥0) Ta có: → a + b = 0,213 → 3a+2b=0,6 a =0,174; b=0,039 Vậy gam; gam |
0,25 0,25 0,25 0,25 |
| 2 (1,0 điểm) |
Gọi n là hóa trị của kim loại M → oxit của M là M2On – Khi cho dung dịch NaOH vào dung dịch Y thu được kết tủa và khối lượng chất rắn khan lớn hơn khối lượng của X → Chất rắn khan là oxit (M2On) – Dung dịch Y sau phản ứng chứa các ion Mn+, K+, có thể có . – Khối lượng oxi trong oxit do M tạo ra là: nO = mol → nM = mol M = → n=2; M=24 (Mg) * mol; * Khi cho dung dịch Y tác dụng với dung dịch NaOH |
0,25 |
nFe3O4 x;nFe2O3 ynHNO3 0,69
0,125
16
16,568 14,568
3 0,0745520,023 0,2091
nFe 3 3 0,7173 0,69
3
nHNO nFe nNO n n mol
H2O 0,5 HNO3 0,345
n n n mol
NO NO
NO muoi axit
0,6
3 3
mFe3O4 2320,05913,688gam;mFe2O3 2,88gam
3nFe3O4 2nF e2O3 nFe(NO3 )3 nFe(NO3 )2 nNO3 (muoi) 3nFe( NO3 )3 2nF e( NO3 )2 0,174.242 42,108
mFe(NO3)3 mFe(NO3)2 0,039.180 7,02SO42 NH 4 0,255
16
13,8 6,12 3,6
n n
n
n
O
2 2.0,255 0,51
.n 12n
0,51
6,12
nMg2 nMg nMgO 0,345
https://bloghoahoc.com – Chuyên trang đề thi thử Hóa Trang 5/5
| OH– + → NH3 + H2O 2OH– + Mg2+ → Mg(OH)2 → mol * Áp dụng bảo toàn điện tích cho dung dịch Y→ =0,095 mol * áp dụng bảo toàn khối lượng: mX + + = m muối trong Y + mT + → = 6,39 gam → mol * Áp dụng bảo toàn nguyên tử hidro: mol * Gọi số mol khí N2 và N2O lần lượt là x,y (x,y>0) Ta có: (1) (2) Từ (1), (2) x= 0,02; y= 0,02 Vậy: |
0,25 0,25 0,25 |
||
| 4 | 1 (1,0 điểm) |
Biện luận: X đơn chức, X + KOH phần rắn và ancol Z Ancol Z bị oxi hóa cho các sản phẩm (anđehit, axit cacboxylic) Z là ancol đơn chức, bậc I X là este. Gọi công thức của X: RCOOCH2-R’ RCOOCH2-R’ + KOH RCOOK + R’-CH2-OH (1) R’-CH2-OH + 1/2O2 R’-CHO + H2O (2) R’-CH2-OH + O2 R’-COOH + H2O (3) Phần 2 R’-COOH + KHCO3 R’-COONa + CO2 + H2O (4) nR’COOH = Phần 3 R’-CH2-OH + Na R’-CH2ONa + 1/2H2 (5) R’-COOH + Na R’-COONa + 1/2H2 (6) H2O + Na NaOH + 1/2H2 (7) TH1: R’ là H, theo phần 1 loại TH2: R’ H Phần 1 R’-CHO + 2AgNO3 + 3NH3 + H2O R’-COONH4 + 2Ag + 2NH4NO3 (8) nR’CHO = 0,1 mol nH2O = 0,2 mol; nancol dư = 0,1 mol *mE = 0,1(R’+67)+0,1(R’+53)+0,2.40 = 25,4 → R’ = 27 (CH2=CH-) . nancol trong D = 0,9 mol Rắn Y gồm (RCOOK: 0,9 mol, KOH dư: 0,3 mol) (R+44+39).0,9 + 0,3.56 = 105 R = 15 R: CH3 Este X: CH3COOCH2CH=CH2 (anlyl axetat) |
0,25 0,25 0,25 0,25 |
| 2 (1,0 điểm) |
Vì A, B đều chứa 2 nhóm chức nên A, B không thể là HCHO và HCOOH → trong muối không thể có (NH4)2CO3 Sau phản ứng luôn có muối NH4NO3 nên sản phẩm của phản ứng giữa A, B với dd AgNO3/NH3 phải tạo ra cùng một muối. |
0,25 |
NH4 2 0,705 0,705 2.0,345 0,015
4
2
4
nOH nNH nMg nNH nK nKNO3 mH 2SO4 mKNO3 mH 2O
mH 2O nH2O 0,355 2 2 4 2 0,4 2.0,105 0,355 0,015
2 4 2 4 2 2
nH SO nH nNH nH O nH 1,47 28 44 1,44
2 2 2
mN mN O mH x y 2 2 2 2 0,08
3 2 2 4
nK NO nN nN O nNH x y .100% 36,36%
0,02 0,02 0,015
0,02
% %
2 2
VN VN O
% 27,28%
2
VH
n mol n mol
KOH Ag 0,2
108
21,6
0,5 2,4 1,2 ;
nCO2 0,1mol
nAg 4nHCHO 20,1 0,2 nHCHO 0,0
https://bloghoahoc.com – Chuyên trang đề thi thử Hóa Trang 6/5
| Gọi công thức của muối đó là R(COONH4)n và số mol của muối này là a mol. → a = 0,2/n Mặt khác ta tính được gam. → → Vì A, B có mạch cacbon không phân nhánh → n =1 hoặc n =2. Khi n = 1 thì R = 31 (R là HO-CH2– ) Khi n = 2 thì R = 62 (không thỏa mãn) Vậy CTCT của A, B là: HO-CH2 – CHO (A) ; HO – CH2 – COOH (B) HO-CH2 – CHO 2Ag nA = nAg/2 = 0,1 mol → nB = 0,1 mol → ; |
0,25 0,25 0,25 |
|
| 1 (1,5 điểm) |
Sản phẩm cháy có CO2 và nước, khi hấp thụ vào dung dịch Ca(OH)2 thu được kết tủa và dung dịch muối → Xảy ra 2 phả ứng: CO2 + Ca(OH)2 CaCO3 + H2O (1) 2CO2 + Ca(OH)2 Ca(HCO3)2 (2) = 5.0,02 = 0,1 (mol); ; mol mol → mol Do khối lượng phần nước lọc tăng so với khối lượng dung dịch Ca(OH)2 ban đầu: ∆mdd tăng = + – 6 = 1,24 (g) → = 1,24 + 6 – 0,14.44 = 1,08 (gam) → = 1,08/18 = 0,06 mol. Trong 3,08 gam A có: = 0,14 (mol); = 0,06.2 = 0,12 (mol); → = (3,08 – 0,14.12 – 0,12)/16 = 0,08; → x : y : z = 0,14 : 0,12 : 0,08 = 7 : 6 : 4 Công thức đơn giản nhất của A là C7H6O4 Do công thức phân tử trùng với công thức đơn giản nhất → Công thức phân tử của A là: C7H6O4 Với công thức phân tử C7H6O4 thoả mãn điều kiện bài ra: + A phản ứng được với NaOH theo tỉ lệ mol A và NaOH là 1 : 4 → A có 4 trung tâm phản ứng với NaOH + A có phản ứng tráng gương → A có nhóm -CHO Vậy A có thể có các công thức cấu tạo sau: |
0,25 0,25 0,25 0,25 0,25 0,25 |
4 3 3
n n mol NH NO AgNO 0,2
n n n n NH NO R C NH NH 4 3 4 3 . 0,4 ( OO )n
mR C NH ( OO ) 4 n 18,6 M n R C NH ( OO ) 4 n 93. M n R 31.
dd / AgNO NH 3 3 n n n A B R C NH ( OO ) 4 n 0,2 2
% 44,12% mHOCH CHO % 55,88% mHOCH C H 2 OO
nCa OH ( )2 nCO2 (1) nCaCO3 0,06 2( ) 2.(0,1 0,06) 0,08
nCO2(2) nCa(OH )2 nCaCO3 nCO2 0,14mCO2 mH O 2 nH O 2 nH O 2 nC nH nO HCOO
OH
OH HCOO
OH
HCOO
OH
HCOO
OH
HO
HCOO
OH
OH
OH
OH
HCOO OH
OH
https://bloghoahoc.com – Chuyên trang đề thi thử Hóa Trang 7/5
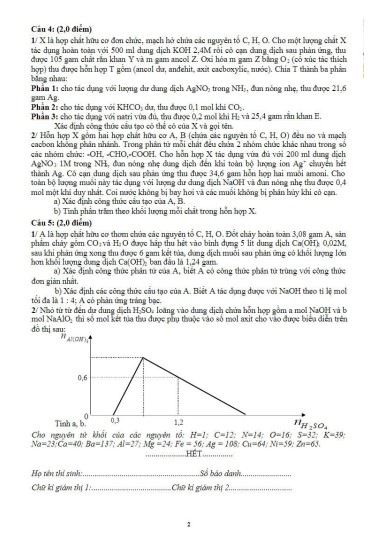
| 5 | 2 (0,5 điểm) |
1) Khi cho từ từ H2SO4 vào dd chứa hỗn hợp NaOH và NaAlO2, các phản ứng xảy ra theo thứ tự: (1) H2SO4 + 2NaOH Na2SO4 + 2H2O (2) H2SO4 + 2NaAlO2 + 2H2O Na2SO4 + 2Al(OH)3 (3) 3H2SO4 + 2Al(OH)3 Al2(SO4)3 + 6H2O Dựa vào đồ thị ta thấy: – Khi mol, NaOH phản ứng vừa hết: nH2SO4=nNaOH/2=a/2=0,3 => a=0,6 (mol) – Khi mol thì kết tủa tan một phần tan=1,2 kết tủa = b – tan=0,6 Với a=0,6 b= 0,9 |
0,25 0,25 |
0,3
2 4
nH SO 1,2
2 4
nH SO 2 4 2 ( )3
3
H SO 2 2 nAl OH
a b
n nAl(OH )3 nAl(OH )3 (Lưu ý: Nếu thí sinh làm các cách khác mà lập luận chặt chẽ, hợp lí thì tính điểm tối đa)
O2 Education gửi các thầy cô link download đề thi
Xem thêm
- Tổng hợp đề thi HSG lớp 12 môn hoá học
- Tổng hợp bài tập vô cơ hay và khó có lời giải chi tiết
- Tổng hợp 50+ bài tập chất béo có lời giải chi tiết
- Tổng hợp bài tập hữu cơ hay và khó có lời giải chi tiết
- Tổng hợp đề thi học kì 2 lớp 12 môn hóa học
- Tổng hợp đề thi học kì 2 lớp 11 môn hóa học
- Tổng hợp đề thi học kì 2 lớp 10 môn hoá học
- Tổng hợp các chuyên đề hóa học lớp 10
- Tổng hợp các chuyên đề hóa học lớp 11
- Tổng hợp các chuyên đề hóa học lớp 12
- Tổng hợp đề thi giữa học kì 2 cả ba khối 10 11 12
- Tổng hợp đề thi THPT QG 2021 file word có lời giải chi tiết
- Tổng hợp các phương pháp giải bài tập môn hoá học

Leave a Reply