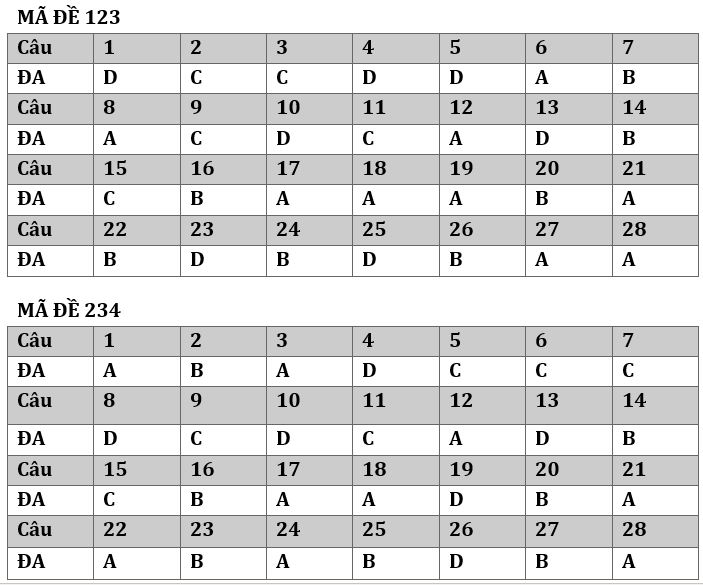
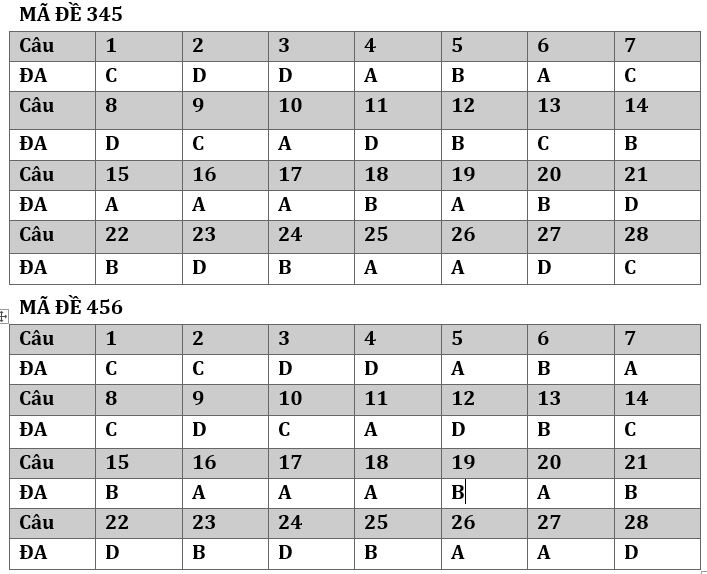
Đề thi HSG môn hóa lớp 10 trường THPT Trần Đại Nghĩa Đắk Lắc Năm 2022 2023
ĐỀ THI VÀ ĐÁP ÁN
Câu 1: ( 4,5 điểm)
1.1. (2,0 điểm): Mỗi phân tử XY2 có tổng các hạt proton, neutron, electron bằng 128; trong phân tử đó, số hạt mang điện nhiều hơn số hạt không mang điện là 36, tổng số hạt mang điện của Y ít hơn tổng số hạt mang điện của X là 18.
a. Hãy xác định kí hiệu hoá học của X,Y, và công thức phân tử XY2 ?
b. Viết cấu hình electron của nguyên tử X,Y,vị trí của chúng trong bảng tuần hoàn và xác định các số lượng tử của electron cuối cùng được điền vào?
1.2.(1,0 điểm): Cho các phân tử sau: CBr4 ; IF5 ; XeF4 ; BrF3. Nêu trạng thái lai hóa của các nguyên tử trung tâm và dạng hình học của các chất trên.
1.3. (1,5 điểm): Một mẫu đồng vị 210Po ở thời điểm t=0 phóng ra 1,736.1014 hạt α trong một giây, sau 7 ngày mẫu đó phóng ra 1,44.1019 hạt α trong một ngày.
a. Viết phương trình phân rã
b Tính khối lượng của Polonium cần lấy lúc đầu để sau 10 ngày ta có một mẫu có tốc độ phóng xạ 1 Ci.
Đáp án và thang điểm câu 1:
| Câu | Hướng dẫn chấm | Điểm |
| Câu 1 1.1 | a/ Kí hiệu số đơn vị điện tích hạt nhân của X là Zx , Y là Zy ; số nơtron của X là Nx , Y là Ny . Với XY2 , ta có các phương trình: 2 Zx + 4 Zy + Nx + 2 Ny = 128 (1) 2 Zx + 4 Zy – Nx – 2 Ny = 36 (2) 2 Zx – 4 Zy = 18 (3) Zy = 8 ; Zx = 25 Vậy X là Mangan, Y là Oxi. XY2 là MnO2 . b/ Cấu hình electron: Mn : [Ar]3d54s2 : Ô 25 , chu kì 4, nhóm VIIB. O: [ He]2s2 2p4 : Ô 8, Chu kì 2,Nhóm VIA Bộ 4 số lượng tử cuối của Mn: n = 3; l = 2; m = 2; ms= +1/2. Bộ 4 số lượng tử cuối của O: n = 2; l = 1; m =-1; ms= -1/2. | 0,25 0,25 0,25 0,25 0,25 0,25 0,25 0,25 |
| 1.2 | CBr4 sp3: Tứ diện đều IF5 sp3d2 : Tháp đáy vuông XeF4 sp3d2: Vuông phẳng BrF3 sp3d: Chữ T | 0,25 0,25 0,25 0,25 |
| 1.3 | a. b. Vo = 1,736.1014 P. rã/s = 1,736 x 1014 x 3600 x 24 = 1,5.1019p.rã/ngày V = 1,44.1019 p.rã/ngày ngày -1 Phương trình phân rã: Xét mẫu Po có V= 1Ci = 3,7.1010 p.rã/s = 3,7.1010 x 3600 x 24 = 3,2 x 1015 p.rã/ngày. (nguyên tử) Vậy NPo phải lấy lúc đầu là (No) ® N0 = N.ekt = 5,488.1017.e0,00583.10 = 5,817.1017 nguyên tử | 0,25 0,25 0,25 0,25 0,25 0,25 |
Câu 2: ( 3,5 điểm)
2.1. (1,5 điểm): Vàng (Au) kết tinh ở dạng lập phương tâm mặt có cạnh của ô mạng cơ sở a = 407 pm (1pm = 10-12 m). Tính khối lượng riêng của tinh thể Au? (Biết Au = 196,97 ; N = 6,022.1023.)
2.2.(2,0 điểm): Tính năng lượng liên kết trong bình C – H từ các kết quả thực hiện nghiệm sau:
– Nhiệt đốt cháy CH4 = – 801,7 kJ/mol
– Nhiệt đốt cháy hidrogen = – 241,5 kJ/mol
– Nhiệt đốt cháy than chì = – 393,4 kJ/mol
– Nhiệt hóa hơi than chì = 715 kJ/mol
– Năng lượng liên kết H – H = 431,5 kJ/mol
Các kết quả đều đo được ở 2980K và 1bar
Đáp án và thang điểm câu 2:
| Câu | Hướng dẫn chấm | Điểm |
| Câu 2 2.1 | Trong 1 ô mạng cơ sở có số nguyên tử Au: nguyên tử (g/cm3) | 0,5 1,0 |
| 2.2 | CH4 + O2 → CO2 + 2H2O 2H2O → O2 + 2H2 – 2 CO2 → O2 + C(r) – C(r) → C(k) 2H2 → 4H 2 CH4 → C(k) + 4H = – 801,7 + 241,5.2 + 393,4 + 715 + 2.(431,5) = 1652,7 kJ/mol Þ | 0,25 0,25 0,25 0,25 0,25 0,25 0,25 0,25 |
Câu 3: ( 4 điểm)
3.1. (2,0 điểm) Thêm từ từ từng giọt dung dịch AgNO3 vào dung dịch chứa KCl 0,1M và KI 0,001M.
a. Kết tủa nào xuất hiện trước.
b. Khi kết tủa thứ 2 bắt đầu tách ra thì nồng độ ion thứ nhất còn lại bằng bao nhiêu?.
Biết pKs(AgI) = 16; pKs(AgCl)=10.
3.2. (2,0 điểm)
a. Tính pH của dung dịch NH3 1,0.10-3 M; Kb=1,8.10-5
b. Tính pH của dung dịch H2S 0,010 M; Ka1=K1=10-7,02; Ka2=K2=10-12,9.
Đáp án và thang điểm câu 3:
| Câu | Hướng dẫn chấm | Điểm |
| Câu 3 3.1 | a. Kết tủa xuất hiện trước. * Nếu AgI kết tủa trước [Ag+].[I–]>Ks(AgI) (M) * Nếu AgCl kết tủa trước [Ag+].[Cl–]>Ks(AgCl) (M) Vậy Ag+ cần kết tủa AgI nhỏ hơn nên AgI kết tủa trước. b. Khi AgCl bắt đầu tách ra thì I– đã kết tủa hoàn toàn trong AgI. | 0,5 0,5 0,25 0,25 0,5 |
| 3.2 | a. NH3 + H2O NH4+ + OH– ; Kb=1,8.10-5 (1) Cb 10-3-x x x H2O H+ + OH– ; K=10-14 (2) Vì KH2O Kb bỏ qua (2) Ta có : Kb= [OH–] = x =1,25.10-4 pOH=3,9 pH=10,1 b. H2S H+ + HS– , K1=10-7,02 (1) HS– H+ + S2- , K2=10-12,9 (2) H2O H+ + OH– , KH2O = 10-14 (3) K1 K2; K1 KH2O CB (1) là chủ yếu, bỏ qua sự điện li của H2O. H2S H+ + HS– , K1=10-7,02 Cb 10-2-x x x K1=10-7,02= [H+]=[HS–]=10-4,51 pH=4,51 | 0,25 0,5 0,25 0,25 0,25 0,25 0,25 |
Câu 4:( 4 điểm)
4.1.(1,5 điểm)
a.Cân bằng phản ứng oxi hoá – khử sau theo phương pháp thăng bằng electron:
1. KMnO4 + FeS2 + H2SO4→ Fe2(SO4)3 + K2SO4 + MnSO4 + H2O.
2. FexOy + H2SO4→Fe2(SO4)3 + SO2 + H2O
b.Cân bằng phản ứng oxi hoá – khử sau theo phương pháp thăng bằng ion-electron:
K2Cr2O7+ Na2SO3 +H2SO4 → Cr2(SO4)3 + Na2SO4 + K2SO4 + H2O
4.2. (2,5 điểm)Người ta lập một pin gồm hai nửa pin sau: Zn/Zn(NO3)2 0,1M và Ag/AgNO3 0,1M có thế khử chuẩn tương ứng là = -0,76V và = +0,80V.
a. Thiết lập sơ đồ pin.
b. Viết phương trình phản ứng khi pin làm việc.
c. Tính suất điện động của pin.
Đáp án và thang điểm câu 4:
O2 Education gửi các thầy cô link download đề thi
Các thầy cô có thể xem thêm nhiều đề thi hsg của các tỉnh khác tại
Tổng hợp đề thi hsg lớp 11 môn hóa học
Tổng hợp đề thi HSG lớp 12 môn hoá học
Hoặc xem thêm các tài liệu khác của môn hóa