Đề thi đại học khối A B môn hóa học năm 2012 và đáp án chi tiết
| BỘ GIÁO DỤC VÀ ĐÀO TẠO ĐỀ CHÍNH THỨC (Đề thi có 06 trang) |
ĐỀ THI TUYỂN SINH ĐẠI HỌC NĂM 2012 Môn: HOÁ HỌC; Khối A Thời gian làm bài: 90 phút, không kể thời gian phát đề |
| Mã đề thi 296 |
Họ, tên thí sinh:……………………………………………………………..…
Số báo danh:………………………………………………………………….
Cho biết nguyên tử khối của các nguyên tố:
H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; S = 32; Cl = 35,5; K = 39; Ca = 40; Cr = 52;
Fe = 56; Cu = 64; Zn = 65; Br = 80; Ag = 108; Ba = 137.
I. PHẦN CHUNG CHO TẤT CẢ THÍ SINH (40 câu, từ câu 1 đến câu 40)
Câu 1: Hiđrat hóa 5,2 gam axetilen với xúc tác HgSO4 trong môi trường axit, đun nóng. Cho toàn bộ
các chất hữu cơ sau phản ứng vào một lượng dư dung dịch AgNO3 trong NH3 thu được 44,16 gam kết
tủa. Hiệu suất phản ứng hiđrat hóa axetilen là
A. 60%. B. 80%. C. 92%. D. 70%.
Câu 2: Cho các phát biểu sau:
(a) Chất béo được gọi chung là triglixerit hay triaxylglixerol.
(b) Chất béo nhẹ hơn nước, không tan trong nước nhưng tan nhiều trong dung môi hữu cơ.
(c) Phản ứng thủy phân chất béo trong môi trường axit là phản ứng thuận nghịch.
(d) Tristearin, triolein có công thức lần lượt là: (C17H33COO)3C3H5, (C17H35COO)3C3H5.
Số phát biểu đúng là
| A. 4. | B. 1. | C. 2. | D. 3. |
| Câu 3: Cho các phản ứng sau: | |||
| (a) H2S + SO2 → | (b) Na2S2O3 + dung dịch H2SO4 (loãng) → |
| (c) SiO2 + Mg ⎯⎯ ⎯to⎯⎯→ | (d) Al | ||
| tØ lÖmol1:2 | 2O3 + dung dịch NaOH → | ||
| (e) Ag + O3 → Số phản ứng tạo ra đơn chất là |
(g) SiO2 + dung dịch HF → | ||
| A. 3. | B. 6. | C. 5. | D. 4. |
Câu 4: Đốt cháy hoàn toàn 3 lít hỗn hợp X gồm 2 anken kế tiếp nhau trong dãy đồng đẳng cần vừa
đủ 10,5 lít O2 (các thể tích khí đo trong cùng điều kiện nhiệt độ, áp suất). Hiđrat hóa hoàn toàn X
trong điều kiện thích hợp thu được hỗn hợp ancol Y, trong đó khối lượng ancol bậc hai bằng 6/13 lần
tổng khối lượng các ancol bậc một. Phần trăm khối lượng của ancol bậc một (có số nguyên tử cacbon
lớn hơn) trong Y là
A. 46,43%. B. 10,88%. C. 31,58%. D. 7,89%.
Câu 5: Một loại phân kali có thành phần chính là KCl (còn lại là các tạp chất không chứa kali) được
sản xuất từ quặng xinvinit có độ dinh dưỡng 55%. Phần trăm khối lượng của KCl trong loại phân kali
đó là
A. 95,51%. B. 65,75%. C. 87,18%. D. 88,52%.
Câu 6: Quặng nào sau đây giàu sắt nhất?
A. Xiđerit. B. Manhetit. C. Hematit đỏ. D. Pirit sắt.
Câu 7: Cho dãy các chất: C6H5NH2 (1), C2H5NH2 (2), (C6H5)2NH (3), (C2H5)2NH (4), NH3 (5)
(C6H5– là gốc phenyl). Dãy các chất sắp xếp theo thứ tự lực bazơ giảm dần là:
A. (3), (1), (5), (2), (4). B. (4), (1), (5), (2), (3).
C. (4), (2), (3), (1), (5). D. (4), (2), (5), (1), (3).
Câu 8: Dãy các kim loại đều có thể được điều chế bằng phương pháp điện phân dung dịch muối (với
điện cực trơ) là:
A. Ni, Cu, Ag. B. Ca, Zn, Cu. C. Li, Ag, Sn. D. Al, Fe, Cr.
Trang 1/6 – Mã đề thi 296
Câu 9: Hỗn hợp X gồm Fe3O4 và Al có tỉ lệ mol tương ứng 1 : 3. Thực hiện phản ứng nhiệt nhôm X
(không có không khí) đến khi phản ứng xảy ra hoàn toàn thu được hỗn hợp gồm
A. Al, Fe, Fe3O4 và Al2O3. B. Al2O3, Fe và Fe3O4.
C. Al2O3 và Fe. D. Al, Fe và Al2O3.
Câu 10: Hỗn hợp X gồm 2 amino axit no (chỉ có nhóm chức –COOH và –NH2 trong phân tử), trong
đó tỉ lệ mO : mN = 80 : 21. Để tác dụng vừa đủ với 3,83 gam hỗn hợp X cần 30 ml dung dịch HCl 1M.
Mặt khác, đốt cháy hoàn toàn 3,83 gam hỗn hợp X cần 3,192 lít O2 (đktc). Dẫn toàn bộ sản phẩm
cháy (CO2, H2O và N2) vào nước vôi trong dư thì khối lượng kết tủa thu được là
A. 13 gam. B. 20 gam. C. 15 gam. D. 10 gam.
Câu 11: Nguyên tử R tạo được cation R+. Cấu hình electron ở phân lớp ngoài cùng của R+ (ở trạng
thái cơ bản) là 2p6. Tổng số hạt mang điện trong nguyên tử R là
A. 10. B. 11. C. 22. D. 23.
Câu 12: Đốt cháy hoàn toàn 4,64 gam một hiđrocacbon X (chất khí ở điều kiện thường) rồi đem toàn
bộ sản phẩm cháy hấp thụ hết vào bình đựng dung dịch Ba(OH)2. Sau các phản ứng thu được 39,4 gam
kết tủa và khối lượng phần dung dịch giảm bớt 19,912 gam. Công thức phân tử của X là
A. CH4. B. C3H4. C. C4H10. D. C2H4.
Câu 13: Cho 500 ml dung dịch Ba(OH)2 0,1M vào V ml dung dịch Al2(SO4)3 0,1M; sau khi các phản
ứng kết thúc thu được 12,045 gam kết tủa. Giá trị của V là
A. 300. B. 75. C. 200. D. 150.
Câu 14: Hỗn hợp X gồm axit fomic, axit acrylic, axit oxalic và axit axetic. Cho m gam X phản ứng
hết với dung dịch NaHCO3 thu được 1,344 lít CO2 (đktc). Đốt cháy hoàn toàn m gam X cần 2,016 lít
O2 (đktc), thu được 4,84 gam CO2 và a gam H2O. Giá trị của a là
A. 1,62. B. 1,44. C. 3,60. D. 1,80.
Câu 15: Cho 2,8 gam bột sắt vào 200 ml dung dịch gồm AgNO3 0,1M và Cu(NO3)2 0,5M; khi các
phản ứng xảy ra hoàn toàn thu được m gam chất rắn X. Giá trị của m là
A. 4,72. B. 4,48. C. 3,20. D. 4,08.
Câu 16: Cho dãy các chất: stiren, ancol benzylic, anilin, toluen, phenol (C6H5OH). Số chất trong dãy
có khả năng làm mất màu nước brom là
A. 5. B. 4. C. 3. D. 2.
Câu 17: Cho các phát biểu sau về phenol (C6H5OH):
(a) Phenol tan nhiều trong nước lạnh.
(b) Phenol có tính axit nhưng dung dịch phenol trong nước không làm đổi màu quỳ tím.
(c) Phenol được dùng để sản xuất phẩm nhuộm, chất diệt nấm mốc.
(d) Nguyên tử H của vòng benzen trong phenol dễ bị thay thế hơn nguyên tử H trong benzen.
(e) Cho nước brom vào dung dịch phenol thấy xuất hiện kết tủa.
Số phát biểu đúng là
A. 4. B. 2. C. 5. D. 3.
Câu 18: Phần trăm khối lượng của nguyên tố R trong hợp chất khí với hiđro (R có số oxi hóa thấp
nhất) và trong oxit cao nhất tương ứng là a% và b%, với a : b = 11 : 4. Phát biểu nào sau đây là đúng?
A. Phân tử oxit cao nhất của R không có cực.
B. Oxit cao nhất của R ở điều kiện thường là chất rắn.
C. Trong bảng tuần hoàn các nguyên tố hóa học, R thuộc chu kì 3.
D. Nguyên tử R (ở trạng thái cơ bản) có 6 electron s.
Câu 19: X và Y là hai nguyên tố thuộc cùng một chu kỳ, hai nhóm A liên tiếp. Số proton của nguyên
tử Y nhiều hơn số proton của nguyên tử X. Tổng số hạt proton trong nguyên tử X và Y là 33. Nhận
xét nào sau đây về X, Y là đúng?
A. Đơn chất X là chất khí ở điều kiện thường.
B. Độ âm điện của X lớn hơn độ âm điện của Y.
C. Lớp ngoài cùng của nguyên tử Y (ở trạng thái cơ bản) có 5 electron.
D. Phân lớp ngoài cùng của nguyên tử X (ở trạng thái cơ bản) có 4 electron.
Câu 20: Điện phân 150 ml dung dịch AgNO3 1M với điện cực trơ trong t giờ, cường độ dòng điện
không đổi 2,68A (hiệu suất quá trình điện phân là 100%), thu được chất rắn X, dung dịch Y và khí Z.
Trang 2/6 – Mã đề thi 296
Cho 12,6 gam Fe vào Y, sau khi các phản ứng kết thúc thu được 14,5 gam hỗn hợp kim loại và khí
NO (sản phẩm khử duy nhất của N+5). Giá trị của t là
A. 0,8. B. 1,2. C. 1,0. D. 0,3.
Câu 21: Phát biểu nào sau đây là đúng?
A. Tất cả các peptit đều có phản ứng màu biure.
B. H2N-CH2-CH2-CO-NH-CH2-COOH là một đipeptit.
C. Muối phenylamoni clorua không tan trong nước.
D. Ở điều kiện thường, metylamin và đimetylamin là những chất khí có mùi khai.
Câu 22: Cho dãy các oxit: NO2, Cr2O3, SO2, CrO3, CO2, P2O5, Cl2O7, SiO2, CuO. Có bao nhiêu oxit
trong dãy tác dụng được với dung dịch NaOH loãng?
A. 7. B. 8. C. 6. D. 5.
Câu 23: Hỗn hợp X có khối lượng 82,3 gam gồm KClO3, Ca(ClO3)2, CaCl2 và KCl. Nhiệt phân hoàn
toàn X thu được 13,44 lít O2 (đktc), chất rắn Y gồm CaCl2 và KCl. Toàn bộ Y tác dụng vừa đủ với
0,3 lít dung dịch K2CO3 1M thu được dung dịch Z. Lượng KCl trong Z nhiều gấp 5 lần lượng KCl
trong X. Phần trăm khối lượng KCl trong X là
A. 12,67%. B. 18,10%. C. 25,62%. D. 29,77%.
Câu 24: Cho các phát biểu sau:
(a) Đốt cháy hoàn toàn este no, đơn chức, mạch hở luôn thu được số mol CO2 bằng số mol H2O.
(b) Trong hợp chất hữu cơ nhất thiết phải có cacbon và hiđro.
(c) Những hợp chất hữu cơ có thành phần nguyên tố giống nhau, thành phần phân tử hơn kém
nhau một hay nhiều nhóm CH2 là đồng đẳng của nhau.
(d) Dung dịch glucozơ bị khử bởi AgNO3 trong NH3 tạo ra Ag.
(e) Saccarozơ chỉ có cấu tạo mạch vòng.
Số phát biểu đúng là
A. 5. B. 3. C. 4. D. 2.
Câu 25: Loại tơ nào sau đây được điều chế bằng phản ứng trùng hợp?
A. Tơ nitron. B. Tơ visco.
C. Tơ xenlulozơ axetat. D. Tơ nilon-6,6.
Câu 26: Xét phản ứng phân hủy N2O5 trong dung môi CCl4 ở 45oC:
N2O5 → N2O4 + 1
2
O2
Ban đầu nồng độ của N2O5 là 2,33M, sau 184 giây nồng độ của N2O5 là 2,08M. Tốc độ trung bình
của phản ứng tính theo N2O5 là
A. 2,72.10–3 mol/(l.s). B. 1,36.10–3 mol/(l.s).
C. 6,80.10–3 mol/(l.s). D. 6,80.10–4 mol/(l.s).
Câu 27: Hòa tan hoàn toàn 2,43 gam hỗn hợp gồm Mg và Zn vào một lượng vừa đủ dung dịch H2SO4
loãng, sau phản ứng thu được 1,12 lít H2 (đktc) và dung dịch X. Khối lượng muối trong dung dịch X là
A. 4,83 gam. B. 5,83 gam. C. 7,33 gam. D. 7,23 gam.
Câu 28: Hòa tan hoàn toàn m gam hỗn hợp gồm Na2O và Al2O3 vào nước thu được dung dịch X
trong suốt. Thêm từ từ dung dịch HCl 1M vào X, khi hết 100 ml thì bắt đầu xuất hiện kết tủa; khi hết
300 ml hoặc 700 ml thì đều thu được a gam kết tủa. Giá trị của a và m lần lượt là
A. 15,6 và 27,7. B. 23,4 và 35,9. C. 23,4 và 56,3. D. 15,6 và 55,4.
Câu 29: Thực hiện các thí nghiệm sau (ở điều kiện thường):
(a) Cho đồng kim loại vào dung dịch sắt(III) clorua.
(b) Sục khí hiđro sunfua vào dung dịch đồng(II) sunfat.
(c) Cho dung dịch bạc nitrat vào dung dịch sắt(III) clorua.
(d) Cho bột lưu huỳnh vào thủy ngân.
Số thí nghiệm xảy ra phản ứng là
A. 3. B. 1. C. 4. D. 2.
Trang 3/6 – Mã đề thi 296
Câu 30: Cho sơ đồ phản ứng:
(a) X + H2O ⎯⎯ xúc tá ⎯c⎯→ Y
(b) Y + AgNO3 + NH3 + H2O → amoni gluconat + Ag + NH4NO3
(c) Y ⎯⎯ xúc tá ⎯c⎯→ E + Z
(d) Z + H2O ⎯⎯ánh sá ⎯⎯⎯ ng ⎯→ X + G
chÊt diÖp lôc
X, Y, Z lần lượt là:
A. Xenlulozơ, fructozơ, cacbon đioxit. B. Xenlulozơ, saccarozơ, cacbon đioxit.
C. Tinh bột, glucozơ, etanol. D. Tinh bột, glucozơ, cacbon đioxit.
Câu 31: Hợp chất X có công thức C8H14O4. Từ X thực hiện các phản ứng (theo đúng tỉ lệ mol):
(a) X + 2NaOH → X1 + X2 + H2O (b) X1 + H2SO4 → X3 + Na2SO4
(c) nX3 + nX4 → nilon-6,6 + 2nH2O (d) 2X2 + X3 → X5 + 2H2O
Phân tử khối của X5 là
A. 174. B. 216. C. 202. D. 198.
Câu 32: Cho các cặp oxi hoá – khử được sắp xếp theo chiều tăng dần tính oxi hoá của dạng oxi hóa
như sau: Fe2+/Fe, Cu2+/Cu, Fe3+/Fe2+. Phát biểu nào sau đây là đúng?
A. Fe2+ oxi hóa được Cu thành Cu2+. B. Cu2+ oxi hoá được Fe2+ thành Fe3+.
C. Fe3+ oxi hóa được Cu thành Cu2+. D. Cu khử được Fe3+ thành Fe.
Câu 33: Cho dãy các chất: Al, Al(OH)3, Zn(OH)2, NaHCO3, Na2SO4. Số chất trong dãy vừa phản
ứng được với dung dịch HCl, vừa phản ứng được với dung dịch NaOH là
A. 5. B. 4. C. 3. D. 2.
Câu 34: Dãy chất nào sau đây đều thể hiện tính oxi hóa khi phản ứng với SO2?
A. Dung dịch BaCl2, CaO, nước brom. B. Dung dịch NaOH, O2, dung dịch KMnO4.
C. O2, nước brom, dung dịch KMnO4. D. H2S, O2, nước brom.
Câu 35: Hiđro hóa hoàn toàn hiđrocacbon mạch hở X thu được isopentan. Số công thức cấu tạo có
thể có của X là
A. 6. B. 7. C. 4. D. 5.
Câu 36: Hỗn hợp M gồm một anken và hai amin no, đơn chức, mạch hở X và Y là đồng đẳng kế tiếp
(MX < MY). Đốt cháy hoàn toàn một lượng M cần dùng 4,536 lít O2 (đktc) thu được H2O, N2 và 2,24 lít
CO2 (đktc). Chất Y là
A. etylamin. B. propylamin. C. butylamin. D. etylmetylamin.
Câu 37: Đốt cháy hoàn toàn 7,6 gam hỗn hợp gồm một axit cacboxylic no, đơn chức, mạch hở và
một ancol đơn chức (có số nguyên tử cacbon trong phân tử khác nhau) thu được 0,3 mol CO2 và
0,4 mol H2O. Thực hiện phản ứng este hóa 7,6 gam hỗn hợp trên với hiệu suất 80% thu được m gam
este. Giá trị của m là
A. 8,16. B. 4,08. C. 2,04. D. 6,12.
Câu 38: Trong ancol X, oxi chiếm 26,667% về khối lượng. Đun nóng X với H2SO4 đặc thu được
anken Y. Phân tử khối của Y là
A. 42. B. 70. C. 28. D. 56.
Câu 39: Cho hỗn hợp K2CO3 và NaHCO3 (tỉ lệ mol 1 : 1) vào bình dung dịch Ba(HCO3)2 thu được kết
tủa X và dung dịch Y. Thêm từ từ dung dịch HCl 0,5M vào bình đến khi không còn khí thoát ra thì hết
560 ml. Biết toàn bộ Y phản ứng vừa đủ với 200 ml dung dịch NaOH 1M. Khối lượng kết tủa X là
A. 3,94 gam. B. 7,88 gam. C. 11,28 gam. D. 9,85 gam.
Câu 40: Cho dãy các hợp chất thơm: p-HO-CH2-C6H4-OH, p-HO-C6H4-COOC2H5, p-HO-C6H4-COOH,
p-HCOO-C6H4-OH, p-CH3O-C6H4-OH. Có bao nhiêu chất trong dãy thỏa mãn đồng thời 2 điều kiện sau?
(a) Chỉ tác dụng với NaOH theo tỉ lệ mol 1 : 1.
(b) Tác dụng được với Na (dư) tạo ra số mol H2 bằng số mol chất phản ứng.
A. 3. B. 4. C. 1. D. 2.
Trang 4/6 – Mã đề thi 296
II. PHẦN RIÊNG (10 câu)
Thí sinh chỉ được làm một trong hai phần riêng (phần A hoặc phần B)
A. Theo chương trình Chuẩn (10 câu, từ câu 41 đến câu 50)
Câu 41: Hóa hơi 8,64 gam hỗn hợp gồm một axit no, đơn chức, mạch hở X và một axit no, đa chức
Y (có mạch cacbon hở, không phân nhánh) thu được một thể tích hơi bằng thể tích của 2,8 gam N2
(đo trong cùng điều kiện nhiệt độ, áp suất). Đốt cháy hoàn toàn 8,64 gam hỗn hợp hai axit trên thu
được 11,44 gam CO2. Phần trăm khối lượng của X trong hỗn hợp ban đầu là
A. 72,22%. B. 27,78%. C. 35,25%. D. 65,15%.
Câu 42: Cho sơ đồ chuyển hóa sau:
(a) C3H4O2 + NaOH → X + Y
(b) X + H2SO4 (loãng) → Z + T
(c) Z + dung dịch AgNO3/NH3 (dư) → E + Ag + NH4NO3
(d) Y + dung dịch AgNO3/NH3 (dư) → F + Ag + NH4NO3
Chất E và chất F theo thứ tự là
A. HCOONH4 và CH3CHO. B. (NH4)2CO3 và CH3COONH4.
| C. HCOONH4 và CH3COONH4. Câu 43: Nhận xét nào sau đây không đúng? |
D. (NH4)2CO3 và CH3COOH. |
A. Vật dụng làm bằng nhôm và crom đều bền trong không khí và nước vì có màng oxit bảo vệ.
B. Crom là kim loại cứng nhất trong tất cả các kim loại.
C. Nhôm và crom đều bị thụ động hóa bởi HNO3 đặc, nguội.
D. Nhôm và crom đều phản ứng với dung dịch HCl theo cùng tỉ lệ số mol.
Câu 44: Cho 100 ml dung dịch AgNO3 2a mol/l vào 100 ml dung dịch Fe(NO3)2 a mol/l. Sau khi phản
ứng kết thúc thu được 8,64 gam chất rắn và dung dịch X. Cho dung dịch HCl dư vào X thu được m gam
kết tủa. Giá trị của m là
A. 22,96. B. 11,48. C. 17,22. D. 14,35.
Câu 45: Cho các phản ứng sau:
(a) FeS + 2HCl → FeCl2 + H2S
(b) Na2S + 2HCl → 2NaCl + H2S
(c) 2AlCl3 + 3Na2S + 6H2O → 2Al(OH)3 + 3H2S + 6NaCl
(d) KHSO4 + KHS → K2SO4 + H2S
(e) BaS + H2SO4 (loãng) → BaSO4 + H2S
Số phản ứng có phương trình ion rút gọn S2- + 2H+ → H2S là
A. 1. B. 3. C. 2. D. 4.
Câu 46: Cho hỗn hợp gồm Fe và Mg vào dung dịch AgNO3, khi các phản ứng xảy ra hoàn toàn thu
được dung dịch X (gồm hai muối) và chất rắn Y (gồm hai kim loại). Hai muối trong X là
A. Mg(NO3)2 và Fe(NO3)2. B. Fe(NO3)3 và Mg(NO3)2.
C. AgNO3 và Mg(NO3)2. D. Fe(NO3)2 và AgNO3.
Câu 47: Đốt cháy hoàn toàn một lượng ancol X tạo ra 0,4 mol CO2 và 0,5 mol H2O. X tác dụng với
Cu(OH)2 tạo dung dịch màu xanh lam. Oxi hóa X bằng CuO tạo hợp chất hữu cơ đa chức Y. Nhận
xét nào sau đây đúng với X?
A. Trong X có 3 nhóm -CH3.
B. Hiđrat hóa but-2-en thu được X.
C. Trong X có 2 nhóm -OH liên kết với hai nguyên tử cacbon bậc hai.
D. X làm mất màu nước brom.
Câu 48: Số amin bậc một có cùng công thức phân tử C3H9N là
A. 3. B. 1. C. 2. D. 4.
Câu 49: Hỗn hợp X gồm H2 và C2H4 có tỉ khối so với H2 là 7,5. Dẫn X qua Ni nung nóng, thu được
hỗn hợp Y có tỉ khối so với H2 là 12,5. Hiệu suất của phản ứng hiđro hoá là
A. 70%. B. 80%. C. 60%. D. 50%.
Câu 50: Dung dịch chất nào sau đây làm quỳ tím chuyển thành màu hồng?
A. Axit aminoaxetic. B. Axit α-aminopropionic.
C. Axit α-aminoglutaric. D. Axit α,ε-điaminocaproic.
Trang 5/6 – Mã đề thi 296
B. Theo chương trình Nâng cao (10 câu, từ câu 51 đến câu 60)
| Câu 51: Cho sơ đồ chuyển hóa: | 3 | KCN | H O 3o + |
| CHCl ⎯⎯ ⎯→ ⎯ X ⎯t⎯→Y. | |||
| Công thức cấu tạo của X, Y lần lượt là: | |||
| A. CH3NH2, CH3COONH4. | B. CH3CN, CH3CHO. |
C. CH3NH2, CH3COOH. D. CH3CN, CH3COOH.
Câu 52: Cho dãy các chất: cumen, stiren, isopren, xiclohexan, axetilen, benzen. Số chất trong dãy
làm mất màu dung dịch brom là
A. 5. B. 4. C. 2. D. 3.
Câu 53: Dung dịch X gồm CH3COOH 0,03M và CH3COONa 0,01M. Biết ở 25oC, Ka của
CH3COOH là 1,75.10-5, bỏ qua sự phân li của nước. Giá trị pH của dung dịch X ở 25oC là
A. 4,28. B. 4,04. C. 4,76. D. 6,28.
| Câu 54: Cho và của pin điện hóa Cu-Ag là o Epin(Zn-Cu) = 1,10V; EoZn2+ /Zn = 0,76V – |
Suất điện động chuẩn | + |
EoAg/Ag = +0,80V.
A. 0,46V. B. 0,56V. C. 1,14V. D. 0,34V.
Câu 55: Cho các phát biểu sau về cacbohiđrat:
(a) Tất cả các cacbohiđrat đều có phản ứng thủy phân.
(b) Thủy phân hoàn toàn tinh bột thu được glucozơ.
(c) Glucozơ, fructozơ và mantozơ đều có phản ứng tráng bạc.
(d) Glucozơ làm mất màu nước brom.
Số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
Câu 56: Nhận xét nào sau đây không đúng?
A. BaSO4 và BaCrO4 hầu như không tan trong nước.
B. Al(OH)3 và Cr(OH)3 đều là hiđroxit lưỡng tính và có tính khử.
C. SO3 và CrO3 đều là oxit axit.
D. Fe(OH)2 và Cr(OH)2 đều là bazơ và có tính khử.
Câu 57: Cho các phát biểu sau:
(a) Khí CO2 gây ra hiện tượng hiệu ứng nhà kính.
(b) Khí SO2 gây ra hiện tượng mưa axit.
(c) Khi được thải ra khí quyển, freon (chủ yếu là CFCl3 và CF2Cl2) phá hủy tầng ozon.
(d) Moocphin và cocain là các chất ma túy.
Số phát biểu đúng là
A. 3. B. 1. C. 2. D. 4.
Câu 58: Cho 18,4 gam hỗn hợp X gồm Cu2S, CuS, FeS2 và FeS tác dụng hết với HNO3 (đặc nóng,
dư) thu được V lít khí chỉ có NO2 (ở đktc, sản phẩm khử duy nhất) và dung dịch Y. Cho toàn bộ Y
vào một lượng dư dung dịch BaCl2, thu được 46,6 gam kết tủa; còn khi cho toàn bộ Y tác dụng với
dung dịch NH3 dư thu được 10,7 gam kết tủa. Giá trị của V là
A. 38,08. B. 24,64. C. 16,8. D. 11,2.
Câu 59: Có các chất sau: keo dán ure-fomanđehit; tơ lapsan; tơ nilon-6,6; protein; sợi bông; amoni
axetat; nhựa novolac. Trong các chất trên, có bao nhiêu chất mà trong phân tử của chúng có chứa
nhóm -NH-CO-?
A. 6. B. 4. C. 3. D. 5.
Câu 60: Khử este no, đơn chức, mạch hở X bằng LiAlH4 thu được ancol duy nhất Y. Đốt cháy hoàn
toàn Y thu được 0,2 mol CO2 và 0,3 mol H2O. Đốt cháy hoàn toàn 0,1 mol X thu được tổng khối
lượng CO2 và H2O là
A. 24,8 gam. B. 16,8 gam. C. 18,6 gam. D. 28,4 gam.
———————————————————- HẾT ———-
Trang 6/6 – Mã đề thi 296
| BỘ GIÁO DỤC VÀ ĐÀO TẠO ĐỀ CHÍNH THỨC (Đề thi có 05 trang) |
ĐỀ THI TUYỂN SINH ĐẠI HỌC NĂM 2012 Môn: HOÁ HỌC; Khối B Thời gian làm bài: 90 phút, không kể thời gian phát đề |
| Mã đề thi 359 |
Họ, tên thí sinh:……………………………………………………………..…
Số báo danh:………………………………………………………………….
Cho biết nguyên tử khối của các nguyên tố: H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27;
S = 32; Cl = 35,5; K = 39; Ca = 40; Cr = 52; Fe = 56; Cu = 64; Zn = 65; Br = 80; Ag = 108; Ba = 137.
I. PHẦN CHUNG CHO TẤT CẢ THÍ SINH (40 câu, từ câu 1 đến câu 40)
Câu 1: Phát biểu nào sau đây là đúng?
A. Tất cả các phản ứng của lưu huỳnh với kim loại đều cần đun nóng.
B. Trong công nghiệp, nhôm được sản xuất từ quặng đolomit.
C. Ca(OH)2 được dùng làm mất tính cứng vĩnh cửu của nước.
D. CrO3 tác dụng với nước tạo ra hỗn hợp axit.
Câu 2: Đốt 5,6 gam Fe trong không khí, thu được hỗn hợp chất rắn X. Cho toàn bộ X tác dụng với
dung dịch HNO3 loãng (dư), thu được khí NO (sản phẩm khử duy nhất) và dung dịch chứa m gam
muối. Giá trị của m là
A. 18,0. B. 22,4. C. 15,6. D. 24,2.
Câu 3: Khi nói về kim loại kiềm, phát biểu nào sau đây là sai?
A. Các kim loại kiềm có màu trắng bạc và có ánh kim.
B. Trong tự nhiên, các kim loại kiềm chỉ tồn tại ở dạng hợp chất.
C. Từ Li đến Cs khả năng phản ứng với nước giảm dần.
D. Kim loại kiềm có nhiệt độ nóng chảy và nhiệt độ sôi thấp.
Câu 4: Đốt cháy hoàn toàn m gam hỗn hợp X gồm hai este đồng phân cần dùng 27,44 lít khí O2, thu
được 23,52 lít khí CO2 và 18,9 gam H2O. Nếu cho m gam X tác dụng hết với 400 ml dung dịch
NaOH 1M, cô cạn dung dịch sau phản ứng thì thu được 27,9 gam chất rắn khan, trong đó có a mol
muối Y và b mol muối Z (MY < MZ). Các thể tích khí đều đo ở điều kiện tiêu chuẩn. Tỉ lệ a : b là
A. 2 : 3. B. 4 : 3. C. 3 : 2. D. 3 : 5.
Câu 5: Thủy phân este X mạch hở có công thức phân tử C4H6O2, sản phẩm thu được có khả
năng tráng bạc. Số este X thỏa mãn tính chất trên là
A. 4. B. 3. C. 6. D. 5.
Câu 6: Thí nghiệm nào sau đây chứng tỏ trong phân tử glucozơ có 5 nhóm hiđroxyl?
A. Khử hoàn toàn glucozơ thành hexan.
B. Cho glucozơ tác dụng với Cu(OH)2.
C. Tiến hành phản ứng tạo este của glucozơ với anhiđrit axetic.
D. Thực hiện phản ứng tráng bạc.
Câu 7: Cho dãy chuyển hóa sau:
| CaC2 ⎯⎯+H2⎯O→X ⎯⎯⎯⎯⎯ o⎯→Y +H Pd/PbCO , t |
Z | +H 2O |
| ⎯⎯⎯⎯→ | ||
| H S O,t | ||
| o |
2 3
2 4 Tên gọi của X và Z lần lượt là
A. axetilen và ancol etylic. B. axetilen và etylen glicol.
C. etan và etanal. D. etilen và ancol etylic.
Câu 8: Điện phân dung dịch hỗn hợp gồm 0,1 mol FeCl3, 0,2 mol CuCl2 và 0,1 mol HCl (điện cực
trơ). Khi ở catot bắt đầu thoát khí thì ở anot thu được V lít khí (đktc). Biết hiệu suất của quá trình
điện phân là 100%. Giá trị của V là
A. 5,60. B. 11,20. C. 22,40. D. 4,48.
Câu 9: Các polime thuộc loại tơ nhân tạo là
A. tơ visco và tơ nilon-6,6. B. tơ tằm và tơ vinilon.
C. tơ nilon-6,6 và tơ capron. D. tơ visco và tơ xenlulozơ axetat.
Câu 10: Đun nóng m gam hỗn hợp gồm a mol tetrapeptit mạch hở X và 2a mol tripeptit mạch hở Y
với 600 ml dung dịch NaOH 1M (vừa đủ). Sau khi các phản ứng kết thúc, cô cạn dung dịch thu được
Trang 1/5 – Mã đề thi 359
72,48 gam muối khan của các amino axit đều có một nhóm –COOH và một nhóm –NH2 trong phân
tử. Giá trị của m là
A. 51,72. B. 54,30. C. 66,00. D. 44,48.
Câu 11: Cho sơ đồ chuyển hoá:
Fe(NO3)3 X Y Z Fe(NO
to
⎯⎯→ ⎯⎯⎯⎯⎯→
+ CO d-, to + FeCl3
⎯⎯⎯⎯→ ⎯⎯+ T⎯→ 3)3
Các chất X và T lần lượt là
A. FeO và NaNO3. B. FeO và AgNO3.
| C. Fe2O3 và Cu(NO3)2. Câu 12: Cho các thí nghiệm sau: (a) Đốt khí H2S trong O2 dư; (c) Dẫn khí F2 vào nước nóng; (e) Khí NH3 cháy trong O2; Số thí nghiệm tạo ra chất khí là |
D. Fe2O3 và AgNO3. |
| (b) Nhiệt phân KClO3 (xúc tác MnO2); (d) Đốt P trong O2 dư; (g) Dẫn khí CO2 vào dung dịch Na2SiO3. |
A. 5. B. 4. C. 2. D. 3.
Câu 13: Cho 21 gam hỗn hợp gồm glyxin và axit axetic tác dụng vừa đủ với dung dịch KOH, thu
được dung dịch X chứa 32,4 gam muối. Cho X tác dụng với dung dịch HCl dư, thu được dung dịch
chứa m gam muối. Giá trị của m là
A. 44,65. B. 50,65. C. 22,35. D. 33,50.
Câu 14: Phát biểu nào sau đây là sai?
A. Nguyên tử kim loại thường có 1, 2 hoặc 3 electron ở lớp ngoài cùng.
B. Các nhóm A bao gồm các nguyên tố s và nguyên tố p.
C. Trong một chu kì, bán kính nguyên tử kim loại nhỏ hơn bán kính nguyên tử phi kim.
D. Các kim loại thường có ánh kim do các electron tự do phản xạ ánh sáng nhìn thấy được.
Câu 15: Cho hỗn hợp X gồm ancol metylic, etylen glicol và glixerol. Đốt cháy hoàn toàn m gam X
thu được 6,72 lít khí CO2 (đktc). Cũng m gam X trên cho tác dụng với Na dư thu được tối đa V lít khí H2
(đktc). Giá trị của V là
A. 3,36. B. 11,20. C. 5,60. D. 6,72.
Câu 16: Số trieste khi thủy phân đều thu được sản phẩm gồm glixerol, axit CH3COOH và axit
C2H5COOH là
A. 9. B. 4. C. 6. D. 2.
Câu 17: Phát biểu nào sau đây là đúng?
A. Hỗn hợp FeS và CuS tan được hết trong dung dịch HCl dư.
B. Thổi không khí qua than nung đỏ, thu được khí than ướt.
C. Photpho đỏ dễ bốc cháy trong không khí ở điều kiện thường.
D. Dung dịch hỗn hợp HCl và KNO3 hoà tan được bột đồng.
Câu 18: Đốt cháy hỗn hợp gồm 1,92 gam Mg và 4,48 gam Fe với hỗn hợp khí X gồm clo và oxi, sau
phản ứng chỉ thu được hỗn hợp Y gồm các oxit và muối clorua (không còn khí dư). Hòa tan Y bằng
một lượng vừa đủ 120 ml dung dịch HCl 2M, thu được dung dịch Z. Cho AgNO3 dư vào dung dịch Z,
thu được 56,69 gam kết tủa. Phần trăm thể tích của clo trong hỗn hợp X là
A. 51,72%. B. 76,70%. C. 53,85%. D. 56,36%.
Câu 19: Oxi hóa 0,08 mol một ancol đơn chức, thu được hỗn hợp X gồm một axit cacboxylic, một
anđehit, ancol dư và nước. Ngưng tụ toàn bộ X rồi chia làm hai phần bằng nhau. Phần một cho tác
dụng hết với Na dư, thu được 0,504 lít khí H2 (đktc). Phần hai cho phản ứng tráng bạc hoàn toàn thu
được 9,72 gam Ag. Phần trăm khối lượng ancol bị oxi hoá là
A. 50,00%. B. 62,50%. C. 31,25%. D. 40,00%.
Câu 20: Nguyên tố Y là phi kim thuộc chu kỳ 3, có công thức oxit cao nhất là YO3. Nguyên tố Y tạo
với kim loại M hợp chất có công thức MY, trong đó M chiếm 63,64% về khối lượng. Kim loại M là
A. Zn. B. Cu. C. Mg. D. Fe.
Câu 21: Đốt cháy hoàn toàn 20 ml hơi hợp chất hữu cơ X (chỉ gồm C, H, O) cần vừa đủ 110 ml khí O2,
thu được 160 ml hỗn hợp Y gồm khí và hơi. Dẫn Y qua dung dịch H2SO4 đặc (dư), còn lại 80 ml khí Z.
Biết các thể tích khí và hơi đo ở cùng điều kiện. Công thức phân tử của X là
A. C4H8O2. B. C4H10O. C. C3H8O. D. C4H8O.
Câu 22: Một dung dịch gồm: 0,01 mol Na+; 0,02 mol Ca2+; 0,02 mol và a mol ion X (bỏ qua
sự điện li của nước). Ion X và giá trị của a là
HCO3–
A. NO3– và 0,03. B. Cl– và 0,01. C. CO32– và 0,03. D. OH– và 0,03.
Trang 2/5 – Mã đề thi 359
Câu 23: Cho phản ứng: N2 (k) + 3H2 (k) R 2NH3 (k); ∆H = –92 kJ. Hai biện pháp đều làm cân
bằng chuyển dịch theo chiều thuận là
A. giảm nhiệt độ và giảm áp suất. B. tăng nhiệt độ và tăng áp suất.
C. giảm nhiệt độ và tăng áp suất. D. tăng nhiệt độ và giảm áp suất.
Câu 24: Hỗn hợp X gồm 0,15 mol vinylaxetilen và 0,6 mol H2. Nung nóng hỗn hợp X (xúc tác Ni)
một thời gian, thu được hỗn hợp Y có tỉ khối so với H2 bằng 10. Dẫn hỗn hợp Y qua dung dịch brom
dư, sau khi phản ứng xảy ra hoàn toàn, khối lượng brom tham gia phản ứng là
A. 0 gam. B. 24 gam. C. 8 gam. D. 16 gam.
Câu 25: Sục 4,48 lít khí CO2 (đktc) vào 1 lít dung dịch hỗn hợp Ba(OH)2 0,12M và NaOH 0,06M.
Sau khi các phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Giá trị của m là
A. 19,70. B. 23,64. C. 7,88. D. 13,79.
Câu 26: Trường hợp nào sau đây xảy ra ăn mòn điện hoá?
A. Sợi dây bạc nhúng trong dung dịch HNO3.
B. Đốt lá sắt trong khí Cl2.
C. Thanh nhôm nhúng trong dung dịch H2SO4 loãng.
D. Thanh kẽm nhúng trong dung dịch CuSO4.
Câu 27: Cho 29 gam hỗn hợp gồm Al, Cu và Ag tác dụng vừa đủ với 950 ml dung dịch HNO3 1,5M,
thu được dung dịch chứa m gam muối và 5,6 lít hỗn hợp khí X (đktc) gồm NO và N2O. Tỉ khối của X
so với H2 là 16,4. Giá trị của m là
A. 98,20. B. 97,20. C. 98,75. D. 91,00.
Câu 28: Đốt cháy hoàn toàn 50 ml hỗn hợp khí X gồm trimetylamin và hai hiđrocacbon đồng đẳng
kế tiếp bằng một lượng oxi vừa đủ, thu được 375 ml hỗn hợp Y gồm khí và hơi. Dẫn toàn bộ Y đi qua
dung dịch H2SO4 đặc (dư), thể tích khí còn lại là 175 ml. Các thể tích khí và hơi đo ở cùng điều kiện.
Hai hiđrocacbon đó là
A. C2H4 và C3H6. B. C3H6 và C4H8. C. C2H6 và C3H8. D. C3H8 và C4H10.
Câu 29: Cho các chất riêng biệt sau: FeSO4, AgNO3, Na2SO3, H2S, HI, Fe3O4, Fe2O3 tác dụng với
dung dịch H2SO4 đặc, nóng. Số trường hợp xảy ra phản ứng oxi hoá – khử là
A. 6. B. 3. C. 4. D. 5.
Câu 30: Cho 0,42 gam hỗn hợp bột Fe và Al vào 250 ml dung dịch AgNO3 0,12M. Sau khi các phản
ứng xảy ra hoàn toàn, thu được dung dịch X và 3,333 gam chất rắn. Khối lượng Fe trong hỗn hợp ban
đầu là
A. 0,168 gam. B. 0,123 gam. C. 0,177 gam. D. 0,150 gam.
Câu 31: Cho 0,125 mol anđehit mạch hở X phản ứng với lượng dư dung dịch AgNO3 trong NH3 thu
được 27 gam Ag. Mặt khác, hiđro hoá hoàn toàn 0,25 mol X cần vừa đủ 0,5 mol H2. Dãy đồng đẳng
của X có công thức chung là
A. CnH2n(CHO)2 (n ≥ 0). B. CnH2n-3CHO (n ≥ 2).
C. CnH2n+1CHO (n ≥ 0). D. CnH2n-1CHO (n ≥ 2).
Câu 32: Cho các chất sau: FeCO3, Fe3O4, FeS, Fe(OH)2. Nếu hoà tan cùng số mol mỗi chất vào dung
dịch H2SO4 đặc, nóng (dư) thì chất tạo ra số mol khí lớn nhất là
A. Fe3O4. B. Fe(OH)2. C. FeS. D. FeCO3.
Câu 33: Đun nóng m gam hỗn hợp X gồm các chất có cùng một loại nhóm chức với 600 ml dung
dịch NaOH 1,15M, thu được dung dịch Y chứa muối của một axit cacboxylic đơn chức và 15,4 gam
hơi Z gồm các ancol. Cho toàn bộ Z tác dụng với Na dư, thu được 5,04 lít khí H2 (đktc). Cô cạn dung
dịch Y, nung nóng chất rắn thu được với CaO cho đến khi phản ứng xảy ra hoàn toàn, thu được
7,2 gam một chất khí. Giá trị của m là
A. 40,60. B. 22,60. C. 34,30. D. 34,51.
Câu 34: Hỗn hợp X gồm hai axit cacboxylic đơn chức. Đốt cháy hoàn toàn 0,1 mol X cần 0,24 mol O2,
thu được CO2 và 0,2 mol H2O. Công thức hai axit là
A. HCOOH và C2H5COOH. B. CH2=CHCOOH và CH2=C(CH3)COOH.
C. CH3COOH và C2H5COOH. D. CH3COOH và CH2=CHCOOH.
Câu 35: Đốt 16,2 gam hỗn hợp X gồm Al và Fe trong khí Cl2 thu được hỗn hợp chất rắn Y. Cho Y vào
nước dư, thu được dung dịch Z và 2,4 gam kim loại. Dung dịch Z tác dụng được với tối đa 0,21 mol
KMnO4 trong dung dịch H2SO4 (không tạo ra SO2). Phần trăm khối lượng của Fe trong hỗn hợp X là
A. 72,91%. B. 64,00%. C. 66,67%. D. 37,33%.
Trang 3/5 – Mã đề thi 359
Câu 36: Hoà tan hoàn toàn 0,1 mol FeS2 trong 200 ml dung dịch HNO3 4M, sản phẩm thu được gồm
dung dịch X và một chất khí thoát ra. Dung dịch X có thể hòa tan tối đa m gam Cu. Biết trong các
quá trình trên, sản phẩm khử duy nhất của N+5 đều là NO. Giá trị của m là
A. 12,8. B. 6,4. C. 9,6. D. 3,2.
Câu 37: Este X là hợp chất thơm có công thức phân tử là C9H10O2. Cho X tác dụng với dung dịch
NaOH, tạo ra hai muối đều có phân tử khối lớn hơn 80. Công thức cấu tạo thu gọn của X là
| A. CH3COOCH2C6H5. B. HCOOC6H4C2H5. Câu 38: Alanin có công thức là |
C. C6H5COOC2H5. | D. C2H5COOC6H5. |
A. C6H5-NH2. B. CH3-CH(NH2)-COOH.
C. H2N-CH2-COOH. D. H2N-CH2-CH2-COOH.
Câu 39: Cho phương trình hóa học: 2X + 2NaOH 2CH
CaO, to
⎯⎯⎯⎯→ 4 + K2CO3 + Na2CO3
Chất X là
A. CH2(COOK)2. B. CH2(COONa)2. C. CH3COOK. D. CH3COONa.
Câu 40: Dẫn luồng khí CO đi qua hỗn hợp gồm CuO và Fe2O3 nung nóng, sau một thời gian thu
được chất rắn X và khí Y. Cho Y hấp thụ hoàn toàn vào dung dịch Ba(OH)2 dư, thu được 29,55 gam
kết tủa. Chất rắn X phản ứng với dung dịch HNO3 dư thu được V lít khí NO (sản phẩm khử duy nhất,
ở đktc). Giá trị của V là
A. 2,24. B. 4,48. C. 6,72. D. 3,36.
II. PHẦN RIÊNG (10 câu)
Thí sinh chỉ được làm một trong hai phần của phần riêng (phần A hoặc phần B)
A. Theo chương trình Chuẩn (10 câu, từ câu 41 đến câu 50)
Câu 41: Cho dãy các chất sau: toluen, phenyl fomat, fructozơ, glyxylvalin (Gly-Val), etylen glicol,
triolein. Số chất bị thuỷ phân trong môi trường axit là
A. 6. B. 3. C. 4. D. 5.
Câu 42: Cho phương trình hóa học (với a, b, c, d là các hệ số):
aFeSO4 + bCl2 → cFe2(SO4)3 + dFeCl3
Tỉ lệ a : c là
A. 4 : 1. B. 3 : 2. C. 2 : 1. D. 3 : 1.
Câu 43: Cho m gam bột sắt vào dung dịch hỗn hợp gồm 0,15 mol CuSO4 và 0,2 mol HCl. Sau khi
các phản ứng xảy ra hoàn toàn, thu được 0,725m gam hỗn hợp kim loại. Giá trị của m là
A. 16,0. B. 18,0. C. 16,8. D. 11,2.
Câu 44: Để điều chế 53,46 kg xenlulozơ trinitrat (hiệu suất 60%) cần dùng ít nhất V lít axit nitric
94,5% (D = 1,5 g/ml) phản ứng với xenlulozơ dư. Giá trị của V là
A. 60. B. 24. C. 36. D. 40.
Câu 45: Có bao nhiêu chất chứa vòng benzen có cùng công thức phân tử C7H8O?
A. 3. B. 5. C. 6. D. 4.
Câu 46: Đốt cháy hoàn toàn hỗn hợp X gồm hai hiđrocacbon (tỉ lệ số mol 1 : 1) có công thức đơn
giản nhất khác nhau, thu được 2,2 gam CO2 và 0,9 gam H2O. Các chất trong X là
A. một ankan và một ankin. B. hai ankađien.
C. hai anken. D. một anken và một ankin.
Câu 47: Cho axit cacboxylic X phản ứng với chất Y thu được một muối có công thức phân tử
C3H9O2N (sản phẩm duy nhất). Số cặp chất X và Y thỏa mãn điều kiện trên là
A. 3. B. 2. C. 4. D. 1.
Câu 48: Phát biểu nào sau đây là sai?
A. Clo được dùng để diệt trùng nước trong hệ thống cung cấp nước sạch.
B. Amoniac được dùng để điều chế nhiên liệu cho tên lửa.
C. Lưu huỳnh đioxit được dùng làm chất chống nấm mốc.
D. Ozon trong không khí là nguyên nhân chính gây ra sự biến đổi khí hậu.
Câu 49: Phát biểu nào sau đây là sai?
A. Cr(OH)3 tan trong dung dịch NaOH.
B. Trong môi trường axit, Zn khử Cr3+ thành Cr.
C. Photpho bốc cháy khi tiếp xúc với CrO3.
D. Trong môi trường kiềm, Br2 oxi hóa CrO2 – thành CrO4 2- .
Trang 4/5 – Mã đề thi 359
Câu 50: Nung nóng 46,6 gam hỗn hợp gồm Al và Cr2O3 (trong điều kiện không có không khí) đến
khi phản ứng xảy ra hoàn toàn. Chia hỗn hợp thu được sau phản ứng thành hai phần bằng nhau. Phần
một phản ứng vừa đủ với 300 ml dung dịch NaOH 1M (loãng). Để hòa tan hết phần hai cần vừa đủ
dung dịch chứa a mol HCl. Giá trị của a là
A. 0,9. B. 1,3. C. 0,5. D. 1,5.
B. Theo chương trình Nâng cao (10 câu, từ câu 51 đến câu 60)
Câu 51: Thủy phân hỗn hợp gồm 0,01 mol saccarozơ và 0,02 mol mantozơ trong môi trường axit,
với hiệu suất đều là 60% theo mỗi chất, thu được dung dịch X. Trung hòa dung dịch X, thu được
dung dịch Y, sau đó cho toàn bộ Y tác dụng với lượng dư dung dịch AgNO3 trong NH3, thu được
m gam Ag. Giá trị của m là
A. 6,480. B. 9,504. C. 8,208. D. 7,776.
Câu 52: Một mẫu khí thải được sục vào dung dịch CuSO4, thấy xuất hiện kết tủa màu đen. Hiện
tượng này do chất nào có trong khí thải gây ra?
A. H2S. B. NO2. C. SO2. D. CO2.
Câu 53: Cho phenol (C6H5OH) lần lượt tác dụng với (CH3CO)2O và các dung dịch: NaOH, HCl, Br2,
HNO3, CH3COOH. Số trường hợp xảy ra phản ứng là
A. 3. B. 4. C. 2. D. 1.
Câu 54: Hoà tan Au bằng nước cường toan thì sản phẩm khử là NO; hoà tan Ag trong dung dịch
HNO3 đặc thì sản phẩm khử là NO2. Để số mol NO2 bằng số mol NO thì tỉ lệ số mol Ag và Au tương
ứng là
A. 1 : 2. B. 3 : 1. C. 1 : 1. D. 1 : 3.
Câu 55: Người ta điều chế H2 và O2 bằng phương pháp điện phân dung dịch NaOH với điện cực trơ,
cường độ dòng điện 0,67A trong thời gian 40 giờ. Dung dịch thu được sau điện phân có khối lượng
100 gam và nồng độ NaOH là 6%. Nồng độ dung dịch NaOH trước điện phân là (giả thiết lượng nước
bay hơi không đáng kể)
A. 5,08%. B. 6,00%. C. 5,50%. D. 3,16%.
Câu 56: Hiđrat hóa 2-metylbut-2-en (điều kiện nhiệt độ, xúc tác thích hợp) thu được sản phẩm chính là
A. 2-metylbutan-2-ol. B. 3-metylbutan-2-ol. C. 3-metylbutan-1-ol. D. 2-metylbutan-3-ol.
Câu 57: Dung dịch chất X không làm đổi màu quỳ tím; dung dịch chất Y làm quỳ tím hóa xanh. Trộn
lẫn hai dung dịch trên thu được kết tủa. Hai chất X và Y tương ứng là
A. KNO3 và Na2CO3. B. Ba(NO3)2 và Na2CO3.
| C. Na2SO4 và BaCl2. Câu 58: Trường hợp nào sau đây tạo ra kim loại? |
D. Ba(NO3)2 và K2SO4. |
A. Đốt FeS2 trong oxi dư.
B. Nung hỗn hợp quặng apatit, đá xà vân và than cốc trong lò đứng.
C. Đốt Ag2S trong oxi dư.
D. Nung hỗn hợp quặng photphorit, cát và than cốc trong lò điện.
Câu 59: Đốt cháy hoàn toàn m gam hỗn hợp X gồm hai ancol, thu được 13,44 lít khí CO2 (đktc) và
15,3 gam H2O. Mặt khác, cho m gam X tác dụng với Na (dư), thu được 4,48 lít khí H2 (đktc). Giá trị
của m là
A. 12,9. B. 15,3. C. 12,3. D. 16,9.
Câu 60: Cho các chất: caprolactam (1), isopropylbenzen (2), acrilonitrin (3), glyxin (4), vinyl axetat (5).
Các chất có khả năng tham gia phản ứng trùng hợp tạo polime là
A. (1), (2) và (3). B. (1), (2) và (5). C. (1), (3) và (5). D. (3), (4) và (5).
———————————————————- HẾT ———-
Trang 5/5 – Mã đề thi 359
O2 Education gửi các thầy cô link download đề thi
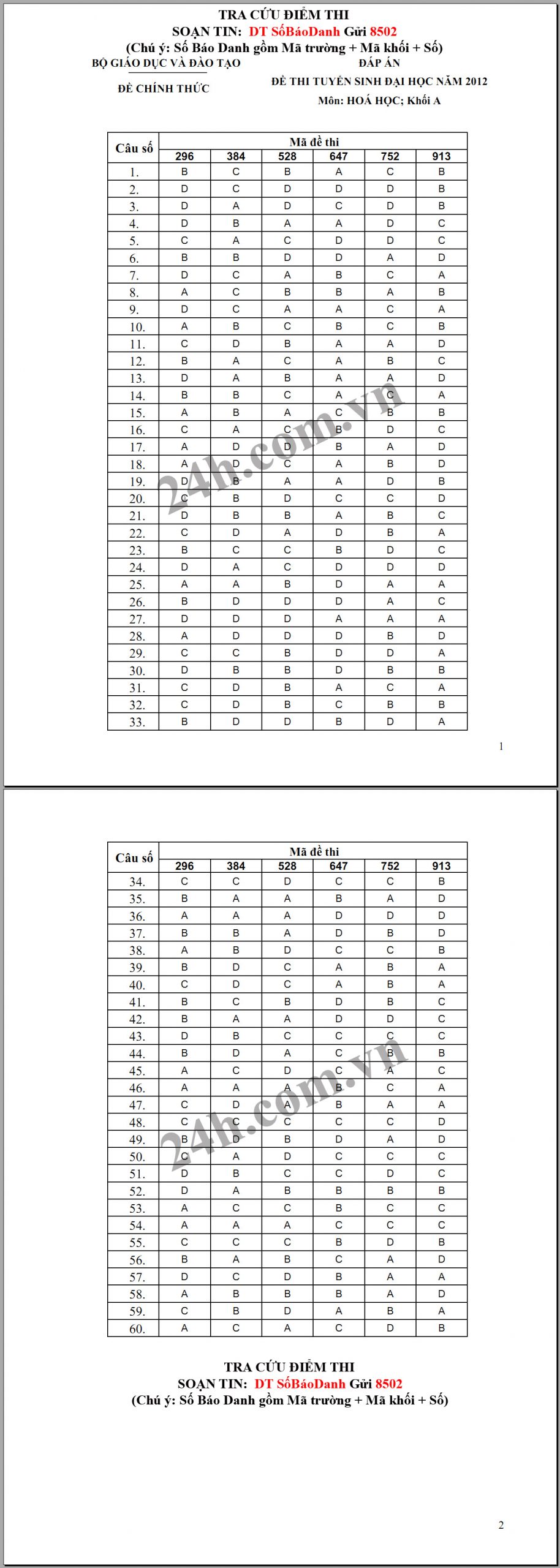
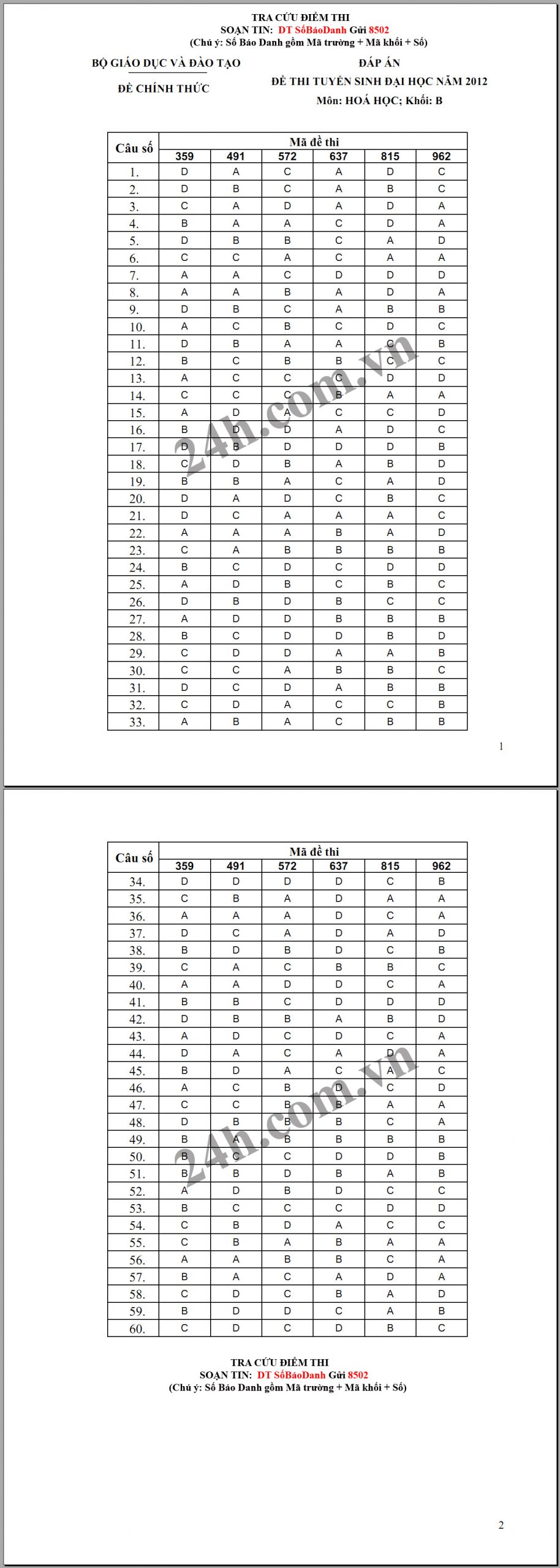
Đáp án
Xem thêm
- Tổng hợp bài tập hữu cơ hay và khó có lời giải chi tiết
- Giải bài tập chất béo theo phương pháp dồn chất
- Tổng hợp 50+ bài tập chất béo có lời giải chi tiết
- Tổng hợp bài tập vô cơ hay và khó có lời giải chi tiết
- Tổng hợp đề thi môn hóa của bộ giáo dục từ năm 2007 đến nay
- Tổng hợp đề thi THPT QG 2021 file word có lời giải chi tiết
- Tổng hợp đề thi học kì 2 lớp 12 môn hóa học
- Tổng hợp đề thi học kì 2 lớp 11 môn hóa học
- Tổng hợp đề thi học kì 2 lớp 10 môn hoá học
- Tổng hợp các chuyên đề hóa học lớp 10
- Tổng hợp các chuyên đề hóa học lớp 11
- Tổng hợp các chuyên đề hóa học lớp 12
- Tổng hợp đề thi giữa học kì 2 cả ba khối 10 11 12
- Tổng hợp các phương pháp giải bài tập môn hoá học
- Tổng hợp đề thi HSG lớp 12 môn hoá học

Leave a Reply