Đề thi học kì 2 môn hóa lớp 10 có bảng đặc tả ma trận và đáp án số 1
|
BỘ GIÁO DỤC VÀ ĐÀO TẠO ĐỀ MINH HỌA |
ĐỀ KIỂM TRA CUỐI KÌ 2 NĂM HỌC 2020 – 2021 Môn thi: Hóa học – Lớp 10 Thời gian làm bài: 45 phút không tính thời gian phát đề |
Họ và tên học sinh:…………………………………… Mã số học sinh:………………………….
Cho nguyên tử khối của các nguyên tố: H =1; C = 12; O =16; Na =23; S = 32; Cl=35,5;
PHẦN TRẮC NGHIỆM
Câu 1: Ở điều kiện thường, clo là chất
A. rắn màu vàng. B. khí không màu.
C. khí màu vàng lục. D. rắn màu lục nhạt.
Câu 2: Công thức của muối natri clorua là
- NaCl. B. KCl. C. NaClO. D. CaOCl2.
Câu 3: Trong bảng tuần hoàn, lưu huỳnh thuộc nhóm VIA. Số electron lớp ngoài cùng của nguyên tử lưu huỳnh là
A. 4. B. 5. C. 6. D. 7.
Câu 4: Lưu huỳnh đioxit có công thức là
- H2S. B. SO3. C. SO2. D. H2SO4.
Câu 5: Số nguyên tử oxi trong phân tử lưu huỳnh trioxit là
- 1. B. 2. C. 3. D. 4.
Câu 6: Ở điều kiện thường, hiđro sunfua là chất
A. khí, mùi trứng thối. B. khí, không mùi.
C. lỏng, mùi trứng thối. D. lỏng, không màu.
Câu 7: Chất nào sau đây nhận biết được ion sunfat ?
- BaCl2. B. HCl. C. KNO3. D. HNO3.
Câu 8: Muốn pha loãng H2SO4 đặc, phải rót
A. từ từ axit vào nước và khuấy nhẹ. B. từ từ nước vào axit và khuấy nhẹ.
C. nhanh axit vào nước và khuấy nhẹ. D. nhanh nước vào axit và khuấy nhẹ.
Câu 9: Hấp thụ SO3 bằng H2SO4 đặc (98%), thu được oleum có công thức dạng
A. H2SO4.nH2O. B. H2SO4.nSO3. C. H2SO4.nSO2. D. H2SO4.
Câu 10: Dẫn khí X vào nước brom, thấy nước brom mất màu. Khí X là
- SO2. B. CO2. C. O2. D. N2.
Câu 11: Để đánh giá mức độ xảy ra nhanh, chậm của các phản ứng hóa học, người ta đưa ra khái niệm
- tốc độ phản ứng. B. cân bằng hóa học.
Câu 12: Khi cho MnO2 vào dung dịch H2O2 thì H2O2 bị phân hủy nhanh hơn, khi đó yếu tố nào đã làm tăng tốc độ phản ứng phân hủy H2O2?
- Áp suất. B. Nhiệt độ. C. Nồng độ. D. Chất xúc tác.
Câu 13: Nếu giữ nguyên các điều kiện khác mà chỉ thay đổi một yếu tố thì yếu tố nào sau đây sẽ làm tăng tốc độ ban đầu của phản ứng?
A. Giảm nhiệt độ của phản ứng. B. Giảm áp suất hệ phản ứng.
C. Tăng nhiệt độ của phản ứng. D. Giảm nồng độ chất phản ứng.
Câu 14: Yếu tố nào sau đây không thể làm chuyển dịch cân bằng hóa học?
- Nhiệt độ. B. Áp suất. C. Chất xúc tác. D. Nồng độ.
Câu 15: Cân bằng hóa học là trạng thái của phản ứng thuận nghịch khi
- tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
- tốc độ phản ứng thuận lớn hơn tốc độ phản ứng nghịch.
- tốc độ phản ứng thuận nhỏ hơn tốc độ phản ứng nghịch.
- các phản ứng thuận và phản ứng nghịch đã kết thúc.
Câu 16: Cho một hạt Zn vào dung dịch H2SO4 loãng, sau đó đun nóng thì
A. bọt khí thoát ra nhanh hơn. B. bọt khí thoát ra chậm hơn.
C. tốc độ thoát khí không đổi. D. kẽm tan chậm hơn.
Câu 17: Trong phản ứng: 3Cl2 + 2Fe 2FeCl3, clo thể hiện
- tính khử mạnh. B. tính khử yếu.
C. tính oxi hóa mạnh. D. cả tính oxi hóa và tính khử.
Câu 18: Khi cho Cl2 tác dụng với dung dịch NaOH ở nhiệt độ thường, thu được dung dịch chứa hai muối nào sau đây?
- KCl và KClO3. B. NaCl và NaClO.
C. NaCl và NaClO3. D. KCl và KClO3.
Câu 19: Muốn thu hồi thủy ngân bị rơi vãi người ta dùng chất nào sau đây?
- S. B. O2. C. Cl2. D. N2.
Câu 20: Hấp thụ hết 0,1 mol SO2 vào dung dịch NaOH dư. Số mol NaOH đã phản ứng là
A. 0,10. B. 0,20. C. 0,15. D. 0,05.
Câu 21: Khi dẫn khí SO2 vào dung dịch H2S thì trong dung dịch xuất hiện
A. kết tủa màu đen. C. kết tủa màu vàng.
B. kết tủa màu trắng. D. kết tủa màu đỏ.
Câu 22: Hoà tan hoàn toàn 5,6 gam Fe cần vừa đủ dung dịch chứa x mol H2SO4 loãng. Giá trị của x là
- 0,10. B. 0,15. C. 0,05 . D. 0,20.
Câu 23: Cho 0,1 mol FeSO4 tác dụng hết với dung dịch BaCl2 dư, thu được m gam kết tủa . Giá trị của m là
A. 23,30. B. 11,65. C. 46,60. D. 34,95.
Câu 24: Trong phản ứng: Cu + 2H2SO4 (đặc, nóng) CuSO4 + SO2 + 2H2O, axit H2SO4 thể hiện tính
- oxi hóa mạnh. B. khử mạnh. C. axit mạnh. D. háo nước.
Câu 25: Tiến hành thí nghiệm: Cho kim loại Cu vào ống nghiệm chứa dung dịch H2SO4 (đặc), đun nhẹ, thấy kim loại Cu tan, có khí thoát ra và dung dịch thu được
- có màu xanh. B. có màu vàng. C. không màu . D. có màu da cam.
Câu 26: Người ta đã lợi dụng yếu tố nào để tăng tốc độ phản ứng khi dùng không khí nén, nóng thổi vào lò cao để đốt cháy than cốc trong sản xuất gang?
- Nhiệt độ và diện tích tiếp xúc. C. Nhiệt độ và áp suất.
- Áp suất và diện tích tiếp xúc. D. Nồng độ và diện tích tiếp xúc.
Câu 27: Hệ cân bằng xảy ra trong bình kín: ∆H > 0. Khi giữ nguyên các điều kiện khác, nếu thêm H2 vào bình phản ứng thì cân bằng sẽ
- chuyển dịch theo chiều thuận. B. chuyển dịch theo chiều nghịch.
C. chuyển dịch theo chiều tăng nồng độ H2. D. không chuyển dịch.
Câu 28: Tiến hành thí nghiệm: Cho một hạt kẽm vào ống nghiệm chứa 3 ml dung dịch HCl 10%. Nếu giữ nguyên các điều kiện khác thì tốc độ phản ứng trong thí nghiệm sẽ tăng khi thay dung dịch HCl 10% bằng dung dịch HCl có nồng độ nào sau đây?
- 6%. B. 8%. C. 5%. D. 15%.
PHẦN TỰ LUẬN
Câu 29 (1 điểm): Cho cân bằng:
Cần tác động các yếu tố (nhiệt độ, nồng độ, áp suất) như thế nào để cân bằng trên chuyển dịch theo chiều thuận? Giải thích.
Câu 30 (1 điểm): Nung nóng 14,4 gam hỗn hợp X gồm Fe và S (trong điều kiện không có oxi), thu được hỗn hợp Y. Hòa tan Y trong dung dịch HCl dư, thu được 4,48 lít hỗn hợp khí. Biết các phản ứng xảy ra hoàn toàn.
a. Viết phương trình phản ứng xảy ra.
b. Tính phần trăm khối lượng các chất trong X.
Câu 31 (0,5 điểm): Khi làm thí nghiệm điều chế các khí H2S và khí Cl2. Một học sinh đề xuất dùng H2SO4 đặc để làm khô hai khí này. Hãy cho biết quan điểm của em về đề xuất trên. Giải thích và viết phương trình phản ứng (nếu có).
Câu 32 (0,5 điểm): Đốt cháy hoàn toàn m gam FeS2 trong O2 thu được Fe2O3 và SO2.. Hấp thụ hết SO2 vào dung dịch chứa 0,015 mol Ba(OH)2, sau khi phản ứng xảy ra hoàn toàn thu được 2,17 gam kết tủa. Tính m.
————– Hết ————–
|
BỘ GIÁO DỤC VÀ ĐÀO TẠO ĐỀ MINH HỌA |
ĐÁP ÁN VÀ HƯỚNG DẪN CHẤM ĐỀ KIỂM TRA CUỐI KÌ 2, NĂM HỌC 2020 – 2021 |
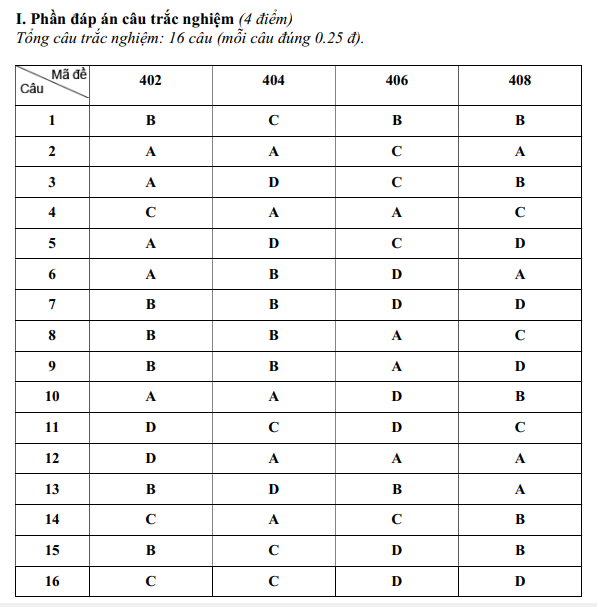
PHẦN TRẮC NGHIỆM
|
Câu |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
|
Đáp án |
C |
A |
C |
C |
C |
A |
A |
A |
B |
A |
A |
D |
C |
C |
|
Câu |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
|
Đáp án |
A |
A |
C |
B |
A |
B |
C |
A |
A |
A |
A |
C |
A |
D |
* Mỗi câu trắc nghiệm đúng được 0,25 điểm.
PHẦN TỰ LUẬN
|
Câu hỏi |
Nội dung |
Điểm |
|
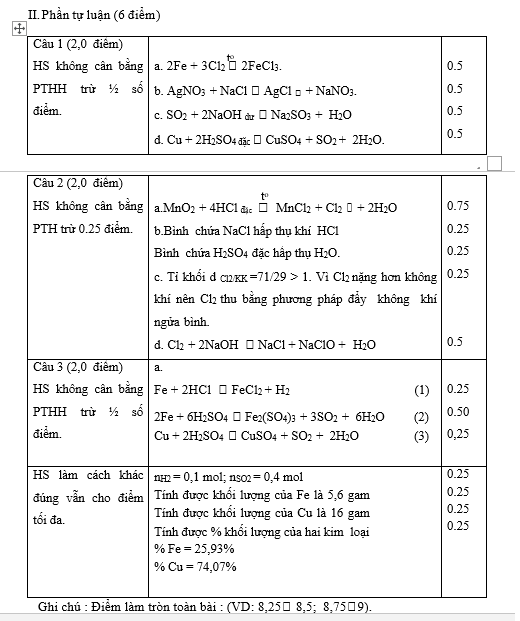
Câu 29 (1 điểm) |
Các yếu tố cần tác động: – Giảm nhiệt độ phản ứng đến nhiệt độ tối ưu vì khi giảm nhiệt độ phản ứng, cân bằng chuyển dịch theo chiều tỏa nhiệt. – Tăng áp suất chung cân bằng chuyển dịch theo chiều số mol khí giảm. – Thêm N2,H2 vào phản ứng vì khi tăng nồng độ chất phản ứng thì cân bằng chuyển dịch theo chiều giảm nồng độ N2,H2. – Lấy bớt NH3 ra ngoài cân bằng chuyển dịch theo chiều làm tăng nồng độ NH3. *Hướng dẫn cách tính điểm của câu hỏi: – Nếu nêu được điều kiện mà không giải thích được thì cho ½ số điểm. – Nêu được 2 điều kiện bất kì và giải thích đúng cho 0,5 điểm – Nêu được 3 hoặc 4 điều kiện nhưng không giải thích được cho 0,5 điểm. |
0,25 0,25 0,25 0,25 |
|
Câu 30 (1 điểm) |
a. Phương trình phản ứng *Rắn Y gồm: Fe, FeS b. Đặt a, b lần lượt là số mol của Fe và S trong 8,8 gam hỗn hợp. Ta có hệ : % = 77,7% % = 22,3% *Hướng dẫn cách tính điểm của câu hỏi: -Nếu viết phương trình mà thiếu điều kiện hoặc không cân bằng thì trừ ½ số điểm. – Nếu tính đúng phần trăm khối lượng của một chất cho ½ số điểm của ý đó. |
0,25 0,25 0,25 0,25 |
|
Câu 31 (0,5 điểm) |
Dùng H2SO4 đặc: – Làm khô được Cl2 vì Cl2 không phản ứng với H2SO4 đặc. – Không làm khô được H2S, vì H2S phản ứng được với H2SO4 đặc. Hoặc *Hướng dẫn cách tính điểm của câu hỏi: – Khi giải thích chỉ cần viết được một phương trình cho điểm tối đa. – Trả lời đúng cả 2 ý nhưng giải thích sai cho 0,25 điểm. |
0,25 0,25
|
|
Câu 32 (0,5 điểm) |
Phương trình phản ứng: Trường hợp 1: 0,01 0,01 ( mol) BTS: = 0,005 mol = 0,005×120 = 0,6 g Trường hợp 2: 0,01 0,01 0,01 ( mol ) 0,01 0,005 ( mol ) BTS: = 0,01 mol = 0,01×120 = 1,2 g *Hướng dẫn cách tính điểm của câu hỏi: – Nếu viết phương trình mà thiếu điều kiện hoặc không cân bằng thì trừ ½ số điểm. – Nếu tính đúng số mol của SO2 nhưng tính sai khối lượng thì cho ½ số điểm. |
0,25 0,25 |
O2 Education gửi các thầy cô và các em link download đề thi
Đáp án Hóa 10 – cuối kì 2 (15-10)
Bảng đặc tả cuối kì 2 – Hóa 10
Xem thêm
- Tổng hợp đề thi học kì 2 lớp 12 môn hóa học
- Tổng hợp đề thi học kì 2 lớp 11 môn hóa học
- Tổng hợp đề thi học kì 2 lớp 10 môn hoá học
- Tổng hợp đề thi môn hóa của bộ giáo dục từ năm 2007 đến nay
- Tổng hợp đề thi THPT QG 2021 file word có lời giải chi tiết
- Tổng hợp bài tập vô cơ hay và khó có lời giải chi tiết
- Tổng hợp 50+ bài tập chất béo có lời giải chi tiết
- Tổng hợp bài tập hữu cơ hay và khó có lời giải chi tiết
- Tổng hợp các chuyên đề hóa học lớp 10
- Tổng hợp các chuyên đề hóa học lớp 11
- Tổng hợp các chuyên đề hóa học lớp 12
- Tổng hợp đề thi giữa học kì 2 cả ba khối 10 11 12
- Tổng hợp các phương pháp giải bài tập môn hoá học
- Tổng hợp đề thi HSG lớp 12 môn hoá học