Giáo án dạy thêm môn hóa lớp 11 học kì 1

Ngày soạn:
Tuần: 1 SỰ ĐIỆN LI
- Những kiến thức học sinh đã biết có liên quan trực tiếp đến bài học:
– Khái niệm chất điện li, phân loại chất điện li, định luật bảo toàn khối lượng
- MỤC TIÊU BÀI HỌC
- Về kiến thức.
Khái niệm về sự điện li, chất điện li, chất điện li mạnh, chất điện li yếu, cân bằng điện li.
- Về kĩ năng:
– Phân biệt được chất điện li, chất không điện li, chất điện li mạnh, chất điện li yếu.
– Viết được phương trình điện li của chất điện li mạnh, chất điện li yếu.
Tính được nồng độ mol các ion trong dung dịch điện li
- Về thái độ
– Rèn luyện tính cẩn thận, học tập nghiêm túc. Hứng thú bộ môn.
4.Về năng lực
– Năng lực tư duy và sử dụng ngôn ngữ hóa học
- CHUẨN BỊ
- Giáo viên: Giáo án và hệ thống câu hỏi, bài tập.
- Học sinh: Ôn lại toàn bộ các kiến thức và chuẩn bị các điều kiện học tập cần thiết
III. NỘI DUNG
- Lý thuyết
- Sự điện li là quá trình phân li các chất trong nước hoặc khi nóng chảy thành ion.
- Dung dịch (dd) dẫn điện được là do trong dung dịch của chúng có các hạt mang điện tích chuyển động tự do được gọi là các ion.
- Chất điện li là những chất khi tan trong nước phân li ra ion.
Axit, bazơ, muối đều là những chất điện li.
Chất điện li mạnh là chất khi tan trong nước, các phân tử hòa tan phân li hoàn toàn.
Các axit mạnh, bazơ mạnh và hầu hết các muối là chất điện li mạnh.
Chất điện li yếu là chất khi tan trong nước, số phân tử hòa tan phân li một phần, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch. Các axit yếu, bazơ yếu và một số muối là chất điện li yếu.
Chất không điện li là những chất khi tan trong nước không phân li ra ion.
Ví dụ: Dung dịch đường, dung dịch rượu, …
- Cân bằng điện li: Sự phân li của các chất điện li yếu là quá trình thuận nghịch. Khi tốc độ phân li của phân tử chất điện li (phản ứng thuận) bằng tốc độ kết hợp giữa các ion thành phân tử chất điện li (phản ứng nghịch) thì cân bằng của quá trình điện li được thiết lập.
- Bài tậpvận dụng
Bài 1. Cho các chất sau: AgNO3, HClO4, KOH, CH3COOH, H2SO4, Fe(OH)3, HgCl2, đường sacarozơ, Ba(OH)2, H3PO4, HClO, HNO3, Cu(OH)2, đường glucozơ, HF, H2SO3, H2S, HBr, Al2(SO4)3, C6H6, CaO. Hãy chỉ ra:
- Chất không điện li.
- Chất điện li yếu.
- Viết phương trình điện li của chất điện li.
HD: HS xem lại định nghĩa về chất điện li, cách viết pt điện li
Bài 2. Cho các dung dịch sau (có cùng nồng độ mol/lít): NaOH, HF, BaCl2, Al2(SO4)3, ancol etylic. Hãy sắp xếp chúng theo thứ tự tăng dần độ dẫn điện.
HD: HS xem lại chất điện li mạnh, chất điện li yếu, chất không điện li
Bài 3. Khi hòa tan một số muối vào nước ta thu được dung dịch X có các ion sau: Na+, Mg2+, Cl–, . Hỏi cần phải hòa tan những muối nào vào nước để thu được dung dịch có 4 ion trên?
HD: HS xem lại lý thuyết
Bài 4. Hòa tan 7,1 gam Na2SO4 ; 7,45 gam KCl ; 2,925 gam NaCl vào nước để được 1 lít dung dịch A.
- Tính nồng độ mol/lít của mỗi ion trong dung dịch A.
- Cần dùng bao nhiêu mol NaCl và bao nhiêu mol K2SO4 để pha thành 400 ml dung dịch muối có nồng độ ion như trong dung dịch A.
- Có thể dùng 2 muối KCl và Na2SO4 để pha thành 400 ml dung dịch muối có nồng độ ion như dung dịch A được không?
HD: HS viết phương trình điện li, tính toán theo phương trình.
- RÚT KINH NGHIỆM
…………………………………………………………………………………………………………………………………..
…………………………………………………………………………………………………………………………………..
…………………………………………………………………………………………………………………………………..
Ngày
Tổ trưởng kí duyệt
Nguyễn Thị Hương
Ngày soạn:
Tuần: 2 SỰ ĐIỆN LI
- Những kiến thức học sinh đã biết có liên quan trực tiếp đến bài học:
– Khái niệm chất điện li, phân loại chất điện li, định luật bảo toàn khối lượng
- MỤC TIÊU BÀI HỌC
- Về kiến thức. HS nhắc lại được các kiến thức về
– Định nghĩa : axit, bazơ, hiđroxit lưỡng tính và muối theo thuyết A-rê-ni-ut.
– Axit một nấc, axit nhiều nấc, muối trung hoà, muối axit.
- Về kĩ năng:
– Phân tích một số thí dụ về axit, bazơ, muối cụ thể, rút ra định nghĩa.
– Nhận biết được một chất cụ thể là axit, bazơ, muối, hiđroxit lưỡng tính, muối trung hoà, muối axit theo định nghĩa.
– Viết được phương trình điện li của các axit, bazơ, muối, hiđroxit lưỡng tính cụ thể.
– Tính nồng độ mol ion trong dung dịch chất điện li mạnh.
- Về thái độ
– Rèn luyện tính cẩn thận, học tập nghiêm túc. Hứng thú bộ môn.
4.Về năng lực
– Năng lực tư duy, sử dụng ngôn ngữ hóa học và năng lực tính toán.
- CHUẨN BỊ
- Giáo viên: Giáo án và hệ thống câu hỏi, bài tập.
- Học sinh: Ôn lại toàn bộ các kiến thức và chuẩn bị các điều kiện học tập cần thiết
III. NỘI DUNG
Phần 2: Bài tập áp dụng
DẠNG 1: VIẾT PHƯƠNG TRÌNH ĐIỆN LI
Bài 1: Cho các chất: KCl, KClO3, BaSO4, Cu(OH)2, H2O, Glixerol, CaCO3, glucozơ. Chất điện li mạnh, chất nào điện li yếu, chất nào không điện li? Viết phương trình điện li.
Bài 2: Viết phương trình điện li của những chất diện li mạnh sau: HClO, KClO3, (NH4)2SO4, NaHCO3, Na3PO4
Bài 3:Viết pt điện ly của các dung dịch sau:
HNO3, H2SO4, HClO4, NaOH, Ba(OH)2, H2S, H2SO3, H3PO4; K2CO3, NaClO, NaHS, Na2HPO4, NaH2PO4, Al(OH)3, Zn(OH)2 , [Ag(NH3)2]Cl, NaHCO3, CH3COOH, (HCOO)2Ca, Cu(OH)2, (NH4)2SO4.
DẠNG 2: TÍNH NỒNG ĐỘ ION TRONG DUNG DỊCH
Bài 1: Tính nồng độ mol/lit của các ion K+, SO42- có trong 2 lit dung dịch chứa 17,4g K2SO4 tan trong nước.
Hưóng dẫn: Nồng độ của K2SO4 là
CM (K2SO4) = 17,4/174.2 = 0,05M
Phương trình điện li: K2SO4 —-> 2K+ + SO42-
0,05 2.0,05 0,05
Vậy [K+] = 0,1M; [SO42- ] = 0,05M
Bài 2: Tính nồng độ mol/l của các ion có trong dung dịch HNO3 10% (Biết D = 1,054 g/ml).
Hướng dẫn: CMHNO3 = = = 1,763M
Phương trình điện li: HNO3 —–> H+ + NO3–
1,673 1,673 1,673
Vậy [H+] = [NO3–] = 1,673M
Bài 3: Tính thể tích dung dịch HCl 0,5M có chứa số mol H+ bằng số mol H+ có trong 0,3 lít dung dịch HNO3 0,2M.
Đáp án VHCl = 0,12 lit
Bài 4: Tính nồng độ mol/l của các ion trong các trường hợp sau:
- Dung dịch CH3COOH 0,01M, độ điện li α = 4,25%
- Dung dịch CH3COOH 0,1M, độ điện li α = 1,34%
Hướng dẫn:
- PTĐL: CH3COOH CH3COO– + H+
Ban đầu 0,01 0 0
Điện li 0,01.α 0,01.α 0,01.α
Cân bằng 0,01 – 0,01.α 0,01.α 0,01.α
Vậy [H+] = 0,01.α = 0,01. 4,25/100 = 0,000425 M
- [H+] = 0,00134 M
Bài 5: Trộn lẫn 100ml dung dịch AlCl3 1M với 200ml dung dịch BaCl2 2M và 300ml dung dịch KNO3 0,5M.
Tính nồng độ mol/l các ion có trong dung dịch thu được sau khi trộn.
Hướng dẫn:
Số mol chất tan trong từng dung dịch:
nAlCl3 = 100.1/1000 = 0,1 mol
nBaCl2 = 200.2/1000 = 0,4 mol
nKNO3 = 300. 0,5/1000 = 0,15 mol
Viết các phương trình điện li, tính số mol các ion tương ứng
V = 100 + 200 + 3000 = 600 ml = 0,6 lit
[Al3+] = 0,1/0,6 = 0,167 mol/l
[Ba2+] = 0,4/0,6 = 0,667 mol/l
[K+] = [NO3–] = 0,15/0,6 = 0,25 mol/l
[Cl– ] = = 1,83 mol/l
Luyện tập:
- Hoà tan 5,85 gam NaCl vào nước để được 200 ml dung dịch X. Hãy tính nồng độ mol các ion trong dd X
- Hoà tan 8,5 gam NaNO3 và 17 gam Cu(NO3)2 vào nước để được 200 ml dung dịch X. Hãy tính nồng độ mol/lit các ion có trong dung dịch
- Hãy tính nồng độ mol các ion trong hỗn hợp dung dịch HCl 0.1M và H2SO4 0.05 M
- Hãy tính nồng độ mol các ion trong hỗn hợp dung dịch NaOH 0.1M và Ba(OH)2 0.025 M
- Trộn 100ml dung dịch NaOH 1M với 300 ml dugn dịch Ba(OH)2 0.025 M thu được dd X. Hãy tính nồng độ mol các ion trong dd X
- Trộn 100ml dung dịch HCl 1M với 100 ml dugn dịch H2SO4 0.05 M thu được dd X. Hãy tính nồng độ mol các ion trong dd X
- Trộn 100ml dung dịch HCl 1M với 100 ml dugn dịch KOH 0.05 M thu được dd X. Hãy tính nồng độ mol các ion trong dd X
- RÚT KINH NGHIỆM
…………………………………………………………………………………………………………………………………..
…………………………………………………………………………………………………………………………………..
…………………………………………………………………………………………………………………………………..
Ngày
Tổ trưởng kí duyệt
Nguyễn Thị Hương
Ngày soạn:
Tuần: 3 SỰ ĐIỆN LI
- Những kiến thức học sinh đã biết có liên quan trực tiếp đến bài học:
– Khái niệm chất điện li, phân loại chất điện li, định luật bảo toàn khối lượng
- MỤC TIÊU BÀI HỌC
- Về kiến thức. HS nhắc lại được các kiến thức về
– Tích số ion của nước, ý nghĩa tích số ion của nước.
– Khái niệm về pH, định nghĩa môi trường axit, môi trường trung tính và môi trường kiềm.
– Chất chỉ thị axit – bazơ : quỳ tím, phenolphtalein và giấy chỉ thị vạn năng
- Về kĩ năng:
– Tính pH của dung dịch axit mạnh, bazơ mạnh.
– Xác định được môi trường của dung dịch bằng cách sử dụng giấy chỉ thị vạn năng, giấy quỳ tím hoặc dung dịch phenolphtalein.
- Về thái độ
– Rèn luyện tính cẩn thận, học tập nghiêm túc. Hứng thú bộ môn.
4.Về năng lực
– Năng lực tư duy, sử dụng ngôn ngữ hóa học và năng lực tính toán.
- CHUẨN BỊ
- Giáo viên: Giáo án và hệ thống câu hỏi, bài tập.
- Học sinh: Ôn lại toàn bộ các kiến thức và chuẩn bị các điều kiện học tập cần thiết
III. NỘI DUNG
Phần 1: Kiến thức cần nhớ
Câu 1: Khái niệm axit – bazơ – muối, hidroxit lưỡng tính theo thuyết Areniut? Cho VD?
Trả lời:
Theo Areniut:
- Axit là những chất khi tan trong nước phân li ra cation H+
VD: HCl, HNO3, H2SO4, HClO, CH3COOH …(HS tự viết pt điện li của các ví dụ)
- Bazơ là những chất khi tan trong nước phân li ra anion OH–
VD: NaOH, KOH, Ba(OH)2, Fe(OH)2 …(HS tự viết pt điện li của các ví dụ)
- Muối là những chất khi tan trong nước phân li ra cation kim loại và anion gốc axit
VD: NaCl, KNO3, (NH4)2SO4, NaClO, CH3COONa …(HS tự viết pt điện li của các ví dụ)
- Hidroxit lưỡng tính là những chất khi tan trong nước vừa có thể phân li như axit, vừa có thể phân li như bazơ
VD:Al(OH)3, Sn(OH)2, Zn(OH)2…(HS tự viết pt điện li của các ví dụ)
Câu 2: pH: khái niệm, công thức, ý nghĩa?
Trả lời: – Công thức tính pH
pH = – log [H+] hay [H+] = 10-pH
Nếu pH = 10– a thì pH = a
- Ý nghĩa pH dùng để xác định môi trường của dung dịch:
+ pH = 7 : Môi trường trung tính
+ pH < 7 : Môi trường axit
+ pH > 7 : Môi trường bazơ
Câu 3: Điều kiện xảy ra phản ứng trao đổi ion trong dung dịch? PT ion thu gọn: ý nghĩa và cách viết pt ion thu gọn?
Trả lời: – Điều kiện xảy ra phản ứng trao đổi ion trong dung dịch
Để xảy ra phản ứng trao đổi ion trong dung dịch chất điện li cần ít nhất tạo ra một trong số các chất sau: + Chất kết tủa, Chất bay hơi, Chất điện li yếu
- PT ion thu gọn: ý nghĩa và cách viết pt ion thu gọn
+ Ý nghĩa: PT ion thu gọn cho biết bản chất của phản ứng xảy ra trong dung dịch các chất điện li
+ Cách viết Pt ion thu gọn: Lược bỏ các ion không tham gia phản ứng, giữ nguyên dạng phân tử với các chất kết tủa, chất bay hơi và chất điện li yếu
Tính pH của dd axit .
PHƯƠNG PHÁP: Tính nồng độ H+ à pH.
Câu 1: Dung dịch có [H+] = 10-5. Dung dịch có môi trường gì?
- Trung tính B. Axit C. Bazo D. Không xác định
Câu 2: Dung dịch có [H+] = 10-9. Dung dịch có môi trường gì?
- Trung tính B. Axit C. Bazo D. Không xác định
Câu 3: Dung dịch H2SO4 0,05M có pH bằng:
- 1 B. 2 C. 1,3 D. 13
Câu 4: Dung dịch X có pH = 4. Nồng độ [H+] bằng:
- 10-10 B. 10-4 C. 10-14 D. Không xác định
Câu 5: Dung dịch X có pH = 2. Nồng độ [OH–] bằng:
- 10-12 B. 10-2 C. 10-14 D. Không xác định
Câu 6: Dung dịch HCl và dung dịch CH3COOH có cùng nồng độ mol/l, pH của hai dung dịch tương ứng là x và y. Quan hệ giữa x và y là (giả thiết, cứ 100 phân tử CH3COOH thì có 1 phân tử điện li) A. y = 100x. B. y = 2x. C. y = x – 2. D. y = x + 2.
Câu 7: Nồng độ mol/l của dung dịch HNO3 có pH = 3 là
- 3 (M) B. -3 (M). C. 10-3(M). D. – lg3 (M).
Câu 8: Một dd có nồng độ H+ bằng 0,001M thì pH và [OH–] của dd này là
- pH = 2; [OH–] =10-10 M. B. pH = 3; [OH–] =10-10M.
- pH = 10-3; [OH–] =10-11M. D. pH = 3; [OH–] =10-11 M.
Đáp án:
| Cấu |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
| Đáp án |
|
|
|
|
|
|
|
|
Tính pH của dd bazơ.
PHƯƠNG PHÁP: Tính nồng độ OH– à nồng độ H+ à pH.
Câu 1: Dd KOH 0,001M có pH bằng:
- 3 B. 11 C. 2 D.12
Câu 2:pH của dd A chứa là:
- 3,3 B. 10,7 C. 3,0 D. 11,0
Câu 3: pH của dd KOH 0,06M và NaOH 0,04M:
- 1 B. 2 C. 13 D. 12,8
Câu 4: pH của dd KOH 0,004M và Ba(OH)2 0,003M:
- 12 B. 2 C. 13 D. 11,6
Câu 5:pH của 500 ml dd chứa 0,2 g NaOH:
- 2 B. 12 C. 0,4 D. 13,6
Câu 6:pH của 800 ml dd chứa 0,548 g Ba(OH)2 :
- 2 B. 12 C. 0,4 D. 13,6
Câu 7:Kết quả nào sau đây sai?
- Dd HCl 4,0.10-3 có pH = 2,4. Dd 2,5.10-4 có pH = 3,3.
- Dd NaOH 3,0.10-4 M có pH = 10,52. Dd 5,0.10-4 M có pH = 11.
Đáp án:
- RÚT KINH NGHIỆM
…………………………………………………………………………………………………………………………………..
…………………………………………………………………………………………………………………………………..
…………………………………………………………………………………………………………………………………..
Ngày
Tổ trưởng kí duyệt
Nguyễn Thị Hương
Ngày soạn:
Tuần: 4 SỰ ĐIỆN LI
- Những kiến thức học sinh đã biết có liên quan trực tiếp đến bài học:
– Khái niệm chất điện li, phân loại chất điện li, định luật bảo toàn khối lượng
- MỤC TIÊU BÀI HỌC
- Về kiến thức.
– Bản chất của phản ứng xảy ra trong dung dịch các chất điện li là phản ứng giữa các ion.
– Để xảy ra phản ứng trao đổi ion trong dung dịch các chất điện li phải có ít nhất một trong các điều kiện: + Tạo thành chất kết tủa.
+ Tạo thành chất điện li yếu.
+ Tạo thành chất khí.
- Về kĩ năng:
– Dự đoán kết quả phản ứng trao đổi ion trong dung dịch các chất điện li.
– Viết được phương trình ion đầy đủ và rút gọn.
– Tính khối lượng kết tủa hoặc thể tích khí sau phản ứng; tính % khối lượng các chất trong hỗn hợp; tính nồng độ mol ion thu được sau phản ứng.
- Về thái độ
– Rèn luyện tính cẩn thận, học tập nghiêm túc. Hứng thú bộ môn.
4.Về năng lực
– Năng lực tư duy và sử dụng ngôn ngữ hóa học
- CHUẨN BỊ
- Giáo viên: Giáo án và hệ thống câu hỏi, bài tập.
- Học sinh: Ôn lại toàn bộ các kiến thức và chuẩn bị các điều kiện học tập cần thiết
III. NỘI DUNG
Phần 1: Kiến thức cần nhớ
- Nêu lại các khái niệm
- Sự điện li: Quá trình phân li các chất tan trong nước ra ion gọi là sự điện li
- Chất điện li yếu, chất điện li mạnh
+ Chất điện li yếu: là những chất khi tan trong nước chỉ một phần các chất tan phân li ra ion, phần còn lại vẫn tồn tại dưới dạng phân tử. Chất điện li yếu gồm: axit yếu và bazơ yếu.
+ Chất điện li mạnh: là những chất khi tan trong nước phân li hoàn toàn ra ion. Chất điện li mạnh gồm: axit mạnh, bazơ tan và hầu hết các muối.
- Nội dung định luật bảo toàn điện tích
Trong một dung dịch:
số mol điện tích dương = số mol điện tích âm
Bài 1. Dung dịch A chứa Al3+ 0,1 mol, Mg2+ 0,15 mol, NO3– 0,3 mol và Cl– a mol . Tính a .
Đáp số: a = 0,3 mol .
Khi cô cạn một dung dịch
+ Không có sự bay hơi hoặc phân hủy chất tan
Khối lượng chất rắn = khối lượng cation (ion dương) + khối lượng anion (ion âm)
Bài 2. Dung dịch A chứa Na+ 0,1 mol , Mg2+ 0,05 mol , SO42- 0,04 mol còn lại là Cl– . Tính khối lượng muối trong dung dịch .
Đáp số: m = 11,6 gam.
+ Có sự bay hơi chất tan
m chất rắn = m cation + m anion – m chất bay hơi
Bài 3. Trong một dung dịch có chứa a mol Ca2+ , b mol Mg2+ , c mol H+ và d mol Cl–
- Lập biểu thức liên hệ giữa a, b, c, và d
- Nếu a = 0,01 ; b = 0,02 và c = 0,03 thì khi đun nóng để cô cạn dung dịch được m gam chất rắn khan. Tìm m?
Đáp số: m chất rắn = m cation + m anion – m HCl bay hơi
+ Có sự phân hủy chất tan
Khối lượng chất rắn = m cation + m anion – m đã mất khi phân hủy
= m cation + m anion (trong chất rắn thu được)
Bài 4.. Trong dung dịch X có chứa 0,1 mol Ca2+ , 0,15 mol Mg2+ , 0,2 mol Cl – và x mol HCO3–
- Tìm x
- Nếu đun sôi để cô cạn X được m g chất rắn, tìm m?
DẠNG 3: ÁP DỤNG ĐỊNH LUẬT BẢO TOÀN ĐIỆN TÍCH.
- Bài tập áp dụng
Phần tự luận:
Bài 1. Một dung dịch có chứa hai loại cation là Fe2+ (0,1 mol) và Al3+ (0,2 mol) cùng hai loại anion là Cl– (x mol) và SO42- (y mol) . Tính x và y biết rằng khi cô cạn dung dịch và làm khan thu được 46,9 gam chất rắn khan .
◙ x = 0,2 (mol) và y = 0,3 (mol)
Bài 2. Trong một dung dịch có chứa a mol Ca2+, b mol Mg2+, c mol Cl–, d mol SO.
- Lập biểu thức liên hệ giữa a, b, c, d.
b.Nếu a = 0,1 ; c = 0,1 ; d = 0,3 thì b bằng bao nhiêu ? Từ kết quả này hãy tính tổng khối lượng các muối có trong dung dịch.
Bài 3. Một dung dịch chứa x mol Cu2+, y mol K+; 0,03 mol Cl– và 0,02 mol SO. Tổng khối lượng các muối tan có trong dung dịch là 5,435 gam. Hãy xác định giá trị x và y.
Bài 4: Có hai dung dịch là dung dịch A và dung dịch B. Mỗi dung dịch chỉ chứa 2 cation và 2 anion trong số các ion sau: (0,15 mol), (0,1 mol), (0,25 mol), (0,2 mol), (0,1 mol), (0,075 mol), (0,25 mol), (0,15 mol). Xác định dung dịch A và dung dịch B.
Bài 5: Dung dịch A chứa a mol , b mol , c mol , d mol , e mol (không kể các ion và của nước).
- a) Lập biểu thức liên hệ giữa a, b, c, d, e.
- b) Thêm (c + d + e) mol Ba(OH)2 vào dung dịch A, đun nóng thu được kết tủa B, dung dịch X và khí Y duy nhất. Tính số mol của mỗi chất trong kết tủa B, khí Y và của mỗi ion trong dung dịch X theo a, b, c, d, e.
Bài 6. Một dung dịch chứa a mol K+, b mol Mg2+, c mol SO và d mol Cl– .
Lập biểu thức liên hệ giữa a, b, c, d và công thức tổng khối lượng muối trong dung dịch.
DÀNH CHO HỌC SINH KHÁ GIỎI
Bài 7. Trong 2 lít dung dịch A chứa 0,2 mol Mg2+ ; x mol Fe3+ ; y mol Cl– và 0,45 mol SO42-. Cô cạn dung dịch X thu được 79 gam muối khan.
- Tính giá trị của x và y?
- Biết rằng để thu được A người ta đã hòa tan 2 muối vào nước. Tính nồng độ mol/lít của mỗi muối trong A.
Bài 8. Khi hòa tan 3 muối X, Y, Z vào nước thu được dung dịch A chứa 0,295 mol Na+ ; 0,0225 mol Ba2+ ; 0,25 mol và a mol .
- Tính a?
- Hãy xác định 3 muối X, Y, Z và tính khối lượng mỗi muối cần hòa tan vào nước để được dung dịch A.
Phần trắc nghiệm
Câu 1. (CĐ 07) Dung dịch A chứa các ion Al3+ = 0,6 mol, Fe2+ = 0,3 mol , Cl – = a mol, SO42- = b mol . Cô cạn dung dịch A thu được 140,7 gam . Gi á trị của a và b lần lượt là
- A. 0,6 ; 0,9 B. 0.9 ; 0,6 C. 0,5 ; 0,3 D. 0,2 ; 0,3
Câu 2: Một dung dịch chứa 0,02 mol , 0,03 mol , x mol và y mol . Tổng khối lượng các muối tan có trong dung dịch là 5,435 gam. Giá trị của x và y lần lượt là
- 0,03 và 0,02. B. 0,05 và 0,01. C. 0,01 và 0,03. D. 0,02 và 0,05.
Câu 3: Dung dịch Z có chứa 5 ion: , , và 0,1 mol , 0,2 mol . Thêm dần V ml dung dịch K2CO3 0,5M vào Z đến khi được lượng kết tủa lớn nhất thì giá trị V tối thiểu cần dùng là
- 150. B. 200. C. 220. D. 300.
Câu 4: Dung dịch Z có chứa 0,015 mol , 0,02 mol , 0,045 mol , 0,01 mol . Khối lượng chất tan trong dung dịch trên là
- 2,4375 gam. B. 3,7575 gam C. 3,3975 gam D. 3,0375 gam
Câu 5: Một dung dịch chứa a mol Ca2+,b mol Na+,c mol HCO3– và d mol Cl–. Biểu thức biểu diễn mối quan hệ giữa a,b,c,d là
- A. a + b = c + d. B.2a + b = c + d. C. a + 2b = c + d. D. a + c = 2b + d.
Câu 6: Một dung dịch có chứa các ion với nồng độ tương ứng như sau: Na+ 0,1M ; Cu2+ 0,2M ; SO42- 0,1M ; xM. Giá trị của x là
- 0,1 M B. 0,2M C.0,3M D.0,4M
Câu 7: Dung dịch X có chứa: a mol Na+, b mol Al3+, c mol Cl– và d mol SO42-. Biểu thức nào sau đây đúng?
- a+b= c+d B. a + 3b = c + 2d C. a + 3b = -(c + 2d). D. a + 3b + c + 2d = 0
Câu 8:Một cốc nước có chứa a mol Ca 2+, b mol Mg2+, c mol Cl–, d mol HCO3–. Hệ thức liên hệ
giữa a, b, c, d là :
- A. 2a+2b=c-d. B. a+b=c+d. C. 2a+2b=c+d. a+b=2c+2d.
DÀNH CHO HỌC SINH KHÁ GIỎI
Câu 9:Có hai dung dịch, mỗi dung dịch chứa hai cation v à 2 anion không trùng nhau trong các ion sau: K+ : 0,3 mol; Mg2+ : 0,2 mol; NH4+ : 0,5 mol; H+ : 0,4 mol; Cl- : 0,2 mol; SO42- : 0,15 mol; : 0,5 mol; CO32- : 0,3 mol. Một trong hai dung dịch tr ên chứa các ion là :
- K+; Mg2+; SO42-; . B. K+; NH4+; ; .
- ; H+ ; ; D. Mg2+ ; H+ ; ; .
Câu 10: Để được một dung dịch có chứa các ion: Mg 2+ (0,02 mol), Fe2+ (0,03 mol), Cl- (0,04 mol), SO42- (0,03 mol), ta có thể pha vào nước mấy muối ?
- A. 2 muối. B. 3 muối. 4 muối. D. 2 hoặc 3 hoặc 4 muối.
Câu 11: Dung dịch A chứa 0,23 gam ion Na +; 0,12 gam ion Mg 2+; 0,355 gam ion Cl – và m gam ion
SO42–. Số gam muối khan sẽ thu đ ược khi cô cạn dung dịch A l à :
- 1,185 gam. B. 1,19 gam. C. 1,2 gam. D. 1,158 gam.
III. HƯỚNG DẪN HỌC BÀI Ở NHÀ
Làm BT trong tờ bài tập:
Đại trà: 4,5 – dạng 2 + 10 câu trắc nghiệm (1 – 10) dạng 3
Nâng cao: 6,7 – dạng 2 + 10 câu trắc nghiệm (11 – 20) dạng 3
- RÚT KINH NGHIỆM
…………………………………………………………………………………………………………………………………..
…………………………………………………………………………………………………………………………………..
…………………………………………………………………………………………………………………………………..
Ngày
Tổ trưởng kí duyệt
Nguyễn Thị Hương
Mời các thầy cô và các em download file giáo án dạy thêm môn hóa lớp 11 học kì 1 đầy đủ chi tiết tại đây
Giáo án dạy thêm hóa học lớp 11-HKI
Xem thêm






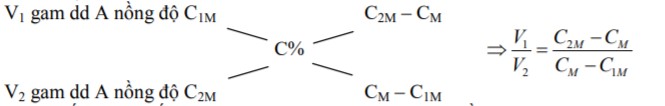
 Trộn V1 lít dd A nồng độ C1M với V2 lít dd A nồng độ C2M thu được (V1+V2) lít dd A nồng độ CM. (với C1M < CM < C2M)
Trộn V1 lít dd A nồng độ C1M với V2 lít dd A nồng độ C2M thu được (V1+V2) lít dd A nồng độ CM. (với C1M < CM < C2M)