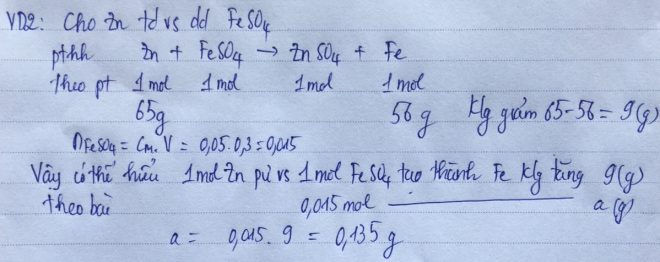Phương pháp bảo toàn nguyên tố
 Xem thêm
Xem thêm
Phương pháp bảo toàn khối lượng
Phương pháp tăng giảm khối lượng
CHUYÊN ĐỀ 1: PHƯƠNG PHÁP B ẢO TOÀN NGUYÊN TỐ
I. Lí thuyết
– Nội dung định luật: Trong phản ứng hóa học, tổng số mol của một nguyên tố trước phản ứng bằng tổng số mol nguyên tố đó sau phản ứng.
VD: Viết biểu thức định luật BTNT cho pt Mg + HCl; Cu + HNO3 loãng.
– Trong phản ứng hóa học, tổng số khối lượng của một nguyên tố trước phản ứng bằng tổng số khối lượng nguyên tố đó sau phản ứng.
– Đối với bài toán hỗn hợp bao gồm nhiều chất xảy ra theo nhiều quá trình khác nhau mà đề bài chỉ cho các dữ kiện liên quan đến chất đầu tiên và chất cuối cùng ta lập sơ đồ sau đó tính toán theo sơ đồ (bỏ qua các phản ứng trung gian).
– Khi áp dụng định luật bảo toàn nguyên tố ta chỉ cần viết sơ đồ phản ứng, không cần cân bằng phương trình hóa học.
* Chú ý
– Dấu hiệu: Cho – hỏi nhiều dữ kiện về số mol của các chất liên quan đến một nguyên tố.
– Khi nhiệt phân các hiđroxit không tạn (kết tủa) sản phẩm thu được là oxit tương ứng và nước (trừ trường hợp đặc biệt Fe(OH)2 khi nhiệt phân trong không khí – pthh minh họa)
– Oxit kim loại + axit muối + H2O nH trong axit = 2nO trong oxit
II. Vận dụng
VD1: Cho a gam CuO tác dụng với dd H2SO4 loãng dư thu được 200 gam dd CuSO4 16%. Tính a (16g)
VD2: Đốt cháy hoàn toàn m gam FeS trong oxi dư thu được a gam khí SO2. Oxi hóa hoàn toàn a gam SO2 thu được b gam SO3. Hấp thụ hết b gam SO3 vào nước thu được 50 gam dd H2SO4 12,25%. Tính m (5,5gam)
VD3: Đốt cháy hoàn toàn 6 gam FeS2 trong oxi dư thu được a gam khí SO2. Oxi hóa hoàn toàn a gam SO2 thu được b gam SO3. Cho b gam SO3 tác dụng hết với dd NaOH dư thu được c gam Na2SO4. Cho c gam Na2SO4 tác dụng hết với dd Ba(OH)2 thu được d gam kết tủa. Tính d (23,3g)
VD4: Cho hỗn hợp A gồm các chất rắn Fe, FeO, Fe3O4, Fe2O3 tan hoàn toàn vào dung dịch HCl dư thu được dung dịch B. Cho dung dịch B tác dụng với dung dịch NaOH dư, lọc kết tủa nung trong không khí đến khối lượng không đổi thu được m gam chất rắn. Tính m nếu số mol mỗi chất là 0,05 mol (28g)
VD5: Cho hỗn hợp 5,6 gam Fe, 6,5 gam Zn, 4,8 gam Mg tác dụng hết với dung dịch HCl thu được dung dịch A. Nhỏ dung dịch NaOH vào dung dịch A đến khi thu được kết tủa lớn nhất B, nung kết tủa B trong không khí đến khối lượng không đổi thu được m gam chất rắn. Tính m.
VD6: Cho 11,2 gam Fe và 2,4 gam Mg tác dụng với dung dịch H2SO4 loãng dư thu được dung dịch A. Cho dung dịch NaOH dư vào dung dịch A thu được kết tủa B. Nung B trong không khí đến khối lượng không đổi thu được m gam chất rắn C. (20g)
VD7: Hoàn tan hoàn toàn 0,2 mol Fe, 0,1 mol Fe2O3 và 0,2 mol Al2O3 vào dung dịch HCl dư thu được dung dịch A. Cho dung dịch A tác dụng với dung dịch NaOH đến khi thu được lượng kết tủa lớn nhất B. Nung B trong không khí đến khối lượng không đổi thu được m gam chất rắn C. Tính m. (52,4g)
VD8: Đem đốt cháy hết x gam Fe ở dạng bột thu được hỗn hợp gồm 3 oxit của sắt. Đem hoàn tan hết lượng oxit này bằng dd HCl dư, sau đó cô cạn dd thu được 162,5 gam FeCl3 và 38,1 gam FeCl2. Tính x (72,8 g)
VD9: Hấp thụ hết V lít CO2(đktc) vào 300 ml dung dịch NaOH x mol/l được 10,6 gam Na2CO3 và 8,4 gam NaHCO3. Tính giá trị của V, x là? (4,48lít và 1M)
VD10: Cho hỗn hợp Fe và FeS tác dụng với dung dịch HCl (dư), thu được 2,464 lít hỗn hợp khí ở điều kiện tiêu chuẩn. Dẫn hỗn hợp khí này qua dung dịch Pb(NO3)2 dư, sinh ra 23,9 gam kết tủa đen. Phần trăm khối lượng của Fe và FeS trong hỗn hợp lần lượt là :
A. 5,98% và 94,02%. B. 94,02% và 5,98%. C. 25% và 75%. D. 75% và 25%.
VD11: Cho hỗn hợp gồm 0,3 mol Fe, 0,15 mol Fe2O3 và 0,1 mol Fe3O4 tác dụng hết với dung dịch H2SO4 loãng thu được dung dịch A. Cho dung dịch A tác dụng với dung dịch NaOH dư, lọc kết tủa đem nung trong không khí đến khối lượng không đổi thu đ ược m gam chất rắn C. Tính m
A. 70. B. 72. C. 65. D. 75.
VD12: Hòa tan hoàn toàn a gam 1 oxit sắt FexOy bằng dd H2SO4 đặc, nóng, vừa đủ có chứa 0,075 mol H2SO4 thu được b gam muối và 168 ml khí không màu mùi hắc (khí SO2) (đktc). CTPT của oxit là?
Bài tập dành cho học sinh lớp 10
Câu 1: Cho hỗn hợp gồm 0,15 mol Fe, 0,075 mol Fe 2O3 và 0,05 mol Fe3O4 tác dụng hết với dung dịch H2SO4 loãng thu được dung dịch A. Cho dung dịch A tác dụng hết với dung dịch NaOH dư, lọc kết tủa đem nung trong không khí đến khối lượng không đổi th u được m gam chất rắn C. Giá trị của m là :
A. 36. B. 72. C. 65. D. 75.
Câu 2: Khử 16 gam Fe2O3 bằng H2 thu được hỗn hợp A gồm Fe, Fe2O3, FeO, Fe3O4. Cho A tác dụng hết với dung dịch H2SO4 đặc, nóng. Khối lượng muối sunfat tạo r a trong dung dịch là :
A. 48 gam. B. 50 gam. C. 32 gam. D. 40 gam.
Câu 3: Hòa tan hoàn toàn hỗn hợp gồm 0,1 mol Fe 2O3 và 0,2 mol FeO vào dung dịch HCl dư thu được dung dịch A. Cho NaOH dư vào dung dịch A thu được kết tủa B. Lọc lấy kết tủa B rồi đem nung trong không khí đ ến khối lượng không đổi được m gam chất rắn, m có giá trị l à:
A. 16 gam. B. 32 gam. C. 48 gam. D. 52 gam.
Câu 4: Cho hỗn hợp X gồm SO 2 và O2 theo tỷ lệ số mol 1:1 đi qua V 2O5 xúc tác, đun nóng thu đư ợc hỗn hợp Y có khối lượng 19,2 gam. Hoà tan Y vào nư ớc sau đó thêm Ba(NO3)2 dư thu được 37,28 gam kết tủa. Hiệu suất phản ứng SO 2 + O2 là :
A. 40%. B. 75%. C. 80%. D. 60%.
III. Bài tập áp dụng
1. Bài tập có lời giải
● Bài tập dành cho học sinh lớp 10
Câu 1: Cho hỗn hợp X gồm 0,15 mol Fe, 0,075 mol Fe2O3 và 0,05 mol Fe3O4 tác dụng hết với dung dịch HCl loãng, thu được dung dịch Y. Cho dung dịch Y tác dụng hết với dung dịch KOH dư, lọc kết tủa đem nung trong không khí đến khối lượng không đổi thu được m gam chất rắn Z. Giá trị của m là :
A. 36. B. 72. C. 65. D. 75.
Câu 2: Cho 1,56 gam hỗn hợp gồm Al và Al2O3 phản ứng hết với dung dịch HCl (dư), thu được V lít khí H2 (đktc) và dung dịch X. Nhỏ từ từ dung dịch NH3 đến dư vào dung dịch X thu được kết tủa, lọc hết lượng kết tủa, nung đến khối lượng không đổi thu được 2,04 gam chất rắn. Giá trị của V là :
A. 0,672. B. 0,224. C. 0,448. D. 1,344.
(Đề thi tuyển sinh Cao đẳng năm 2010)
Câu 3: Cho V lít hỗn hợp khí gồm H2S và SO2 tác dụng với dung dịch brom dư. Thêm dung dịch BaCl2 dư vào hỗn hợp trên thì thu được 2,33 gam kết tủa. Giá trị của V là :
A. 0,112 lít. B. 2,24 lít. C. 1,12 lít. D. 0,224 lít.
Câu 4: Cho hỗn hợp Fe và FeS tác dụng với dung dịch HCl (dư), thu được 2,464 lít hỗn hợp khí (đktc). Dẫn hỗn hợp khí này qua dung dịch Pb(NO3)2 dư, sinh ra 23,9 gam kết tủa đen. Phần trăm khối lượng của Fe và FeS trong hỗn hợp lần lượt là :
A. 94,02% và 5,98%. B. 5,98% và 94,02%.
C. 25% và 75%. D. 75% và 25%.
Câu 5: Cho hỗn hợp X gồm SO2 và O2 theo tỷ lệ số mol 1:1 đi qua V2O5 xúc tác, đun nóng thu được hỗn hợp Y có khối lượng 19,2 gam. Hoà tan Y vào nước sau đó thêm Ba(NO3)2 dư thu được 37,28 gam kết tủa. Hiệu suất phản ứng giữa SO2 và O2 là :
A. 40%. B. 75%. C. 80%. D. 60%.
Câu 6: Hòa tan hỗn hợp X gồm 11,2 gam Fe và 2,4 gam Mg bằng dung dịch H2SO4 loãng (dư), thu được dung dịch Y. Cho dung dịch NaOH dư vào Y thu được kết tủa Z. Nung Z trong không khí đến khối lượng không đổi, thu được m gam chất rắn. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của m là
A. 24. B. 20. C. 36. D. 18.
(Đề thi tuyển sinh Đại học khối B năm 2013)
Câu 7: Đem 11,2 gam Fe để ngoài không khí, sau một thời gian thu được một hỗn hợp gồm Fe và các oxit. Hòa tan hoàn toàn hỗn hợp đó trong dung dịch H2SO4 đặc, nóng dư thu được 3,36 lít khí SO2 (đktc). Số mol H2SO4 đã tham gia phản ứng là :
A. 0,4 mol. B. 0,3 mol. C. 0,5 mol. D. 0,45 mol.
Câu 8: Cho 6 lít hỗn hợp CO2 và N2 (đktc) đi qua dung dịch KOH tạo ra 2,07 gam K2CO3 và 6 gam KHCO3. Thành phần phần trăm về thể tích của CO2 trong hỗn hợp là :
A. 42%. B. 56%. C. 28%. D. 50%.
Câu 9: Dùng khí CO để khử hoàn toàn 2,88 gam hỗn hợp X gồm Fe, FeO, Fe2O3 thu được 2,24 gam chất rắn. Mặt khác, để hòa tan hết 2,88 gam X cần vừa đủ 100 ml dung dịch HCl, kết thúc thí nghiệm thu được 224 ml khí (đktc). Nồng độ mol/lít của dung dịch HCl là :
A. 1. B. 0,5. C. 1,6. D. 0,8.
(Đề thi thử đại học lần 2 – THPT Chuyên – Đại học SPHN, năm học 2011 – 2012)
Câu 10: Hỗn hợp X gồm Fe3O4, FeO, Fe2O3, CuO. Lấy 46,7 gam X khử hóa hoàn toàn bằng H2 thì thu được 9 gam H2O. Cũng lấy 46,7 gam X tác dụng với dung dịch HCl dư, rồi cô cạn dung dịch sau phản ứng thì thu được khối lượng muối khan thu được là
A. 64,95 gam. B. 82,2 gam. C. 74,2 gam. D. 96,8 gam.
(Đề thi thử đại học lần 1 – THPT Chuyên – Đại học Vinh, năm học 2011 – 2012)
● Bài tập dành cho học sinh lớp 11
Câu 11: Cho m gam hỗn hợp Mg, Al vào 250 ml dung dịch X chứa hỗn hợp axit HCl 1M và axit H2SO4 0,5M, thu được 5,32 lít H2 (ở đktc) và dung dịch Y (coi thể tích dung dịch không đổi). Dung dịch Y có pH là :
A. 1. B. 6. C. 7. D. 2.
(Đề thi tuyển sinh Đại học khối A năm 2007)
Câu 12: Cho 150 ml dung dịch KOH 1,2M tác dụng với 100 ml dung dịch AlCl3 nồng độ x mol/l, thu được dung dịch Y và 4,68 gam kết tủa. Loại bỏ kết tủa, thêm tiếp 175 ml dung dịch KOH 1,2M vào Y, thu được 2,34 gam kết tủa. Giá trị của x là
A. 1,2. B. 0,8. C. 0,9. D. 1,0.
(Đề thi tuyển sinh Đại học khối B năm 2010)
Câu 13: Hoà tan hoàn toàn hỗn hợp m gam hỗn hợp gồm FeS2 và Cu2S vào axit HNO3 (vừa đủ), thu được dung dịch X (chỉ chứa hai muối sunfat) với tổng khối lượng là 72 gam. Giá trị của m là :
A. 80. B. 20. C. 60. D. 40.
(Đề thi thử đại học lần 4 – THPT Chuyên – Đại học Vinh, năm học 2010 – 2011)
Câu 14: Đun nóng m gam hỗn hợp Cu và Fe có tỉ lệ khối lượng tương ứng 7 : 3 với một lượng dung dịch HNO3. Khi các phản ứng kết thúc, thu được 0,75m gam chất rắn, dung dịch X và 5,6 lít hỗn hợp khí (đktc) gồm NO và NO2 (không có sản phẩm khử khác của N+5). Biết lượng HNO3 đã phản ứng là 44,1 gam. Giá trị của m là :
A. 44,8. B. 40,5. C. 33,6. D. 50,4.
(Đề thi tuyển sinh Đại học khối A năm 2011)
Câu 15*: Hấp thụ hết V lít khí CO2 vào dung dịch chứa 0,42 mol Ca(OH)2 thu được a gam kết tủa. Tách lấy kết tủa, sau đó thêm tiếp 0,6V lít khí CO2 nữa, thu thêm 0,2a gam kết tủa. Thể tích các khí đo ở đktc. Giá trị của V là:
A. 7,84 lít. B. 5,60 lít. C. 6,72 lít. D. 8,40 lít.
(Đề thi thử đại học lần 4 – THPT Chuyên Nguyễn Huệ – Hà Nội, năm học 2011 – 2012)
Câu 16: Đốt cháy hoàn toàn m gam hỗn hợp X gồm C2H2, C3H6, C6H6 cần vừa đúng V lít không khí (đktc). Hấp thụ toàn bộ sản phẩm cháy vào bình đựng nước vôi trong dư thu được a gam kết tủa. Biết không khí gồm có 20% oxi và 80% nitơ theo thể tích. Biểu thức liên hệ giữa m với V và a là
A. B. C. D.
Đề thi thử đại học lần 1 – THPT Đô Lương 1 – Nghệ An, năm học 2012 – 2013)
Câu 17: Cho 0,5 lít hỗn hợp gồm hiđrocacbon và khí cacbonic vào 2,5 lít oxi (lấy dư) rồi đốt. Thể tích của hỗn hợp thu được sau khi đốt là 3,4 lít. Cho hỗn hợp qua thiết bị làm lạnh, thể tích hỗn hợp khí còn lại 1,8 lít và cho lội qua dung dịch KOH chỉ còn 0,5 lít khí. Thể tích các khí được đo trong cùng điều kiện. Tên gọi của hiđrocacbon là :
A. propan. B. xiclobutan. C. propen. D. xiclopropan.
Câu 18: Cho 224,00 lít metan (đktc) qua hồ quang được V lít hỗn hợp A (đktc) chứa 12% C2H2; 10% CH4; 78% H2 (về thể tích). Giả sử chỉ xảy ra 2 phản ứng :
2CH4 ® C2H2 + 3H2 (1)
CH4 ® C + 2H2 (2)
Giá trị của V là :
A. 407,27. B. 448,00. C. 520,18. D. 472,64.
Câu 19: Đốt cháy hoàn toàn m gam hỗn hợp X gồm hai ancol, thu được 13,44 lít khí CO2 (đktc) và 15,3 gam H2O. Mặt khác, cho m gam X tác dụng với Na (dư), thu được 4,48 lít khí H2 (đktc). Giá trị của m là
A. 12,9 . B. 15,3. C. 12,3. D. 16,9.
(Đề thi tuyển sinh Đại học khối B năm 2012)
Câu 20*: Hỗn hợp X gồm 0,01 mol HCOONa và a mol muối natri của hai axit no, đơn chức, mạch hở là đồng đẳng liên tiếp. Đốt cháy hoàn toàn hỗn hợp X, cho sản phẩm khí và hơi lần lượt qua bình 1 đựng H2SO4 đặc, bình 2 đựng KOH thấy khối lượng bình 2 tăng nhiều hơn bình một là 3,51 gam. Phần chất rắn còn lại sau khi đốt cháy X có khối lượng là 2,65 gam. Công thức phân tử của hai muối natri là :
A. C2H5COONa và C3H7COONa. B. C3H7COONa và C4H9COONa.
C. CH3COONa và C2H5COONa. D. CH3COONa và C3H7COONa.
(Đề thi thử Đại học lần 1 – THPT Chuyên Hùng Vương – Phú Thọ, năm học 2009 – 2010)
● Bài tập dành cho học sinh lớp 12
Câu 21: Cho 0,1 mol CH3COOH vào cốc chứa 30 ml dung dịch ROH 20% (d =1,2 g/ml, R là một kim loại kiềm). Cô cạn dung dịch sau phản ứng, rồi đốt cháy hoàn toàn chất rắn khan còn lại. Sau khi đốt cháy thì còn lại 9,54 gam chất rắn và có m gam hỗn hợp gồm CO2, hơi nước bay ra. Giá trị của m là :
A. 10,02. B. 9,3. C. 7,54. D. 8,26.
(Đề thi thử Đại học lần 1 – THPT Chuyên KHTN, năm học 2011 – 2012)
Câu 22*: Cho 2,76 gam chất hữu cơ X gồm C, H, O tác dụng với dung dịch NaOH vừa đủ sau đó chưng khô thì phần bay hơi chỉ có nước và còn lại 2 muối của Na có khối lượng 4,44 gam. Nung nóng 2 muối này trong oxi dư, phản ứng hoàn toàn thu được 2,464 lít CO2 (đktc); 3,18 gam Na2CO3 và 0,9 gam H2O. Biết công thức phân tử của X trùng với công thức đơn giản nhất. Cho 2,76 gam X tác dụng với 80 ml dung dịch KOH 1M, cô cạn dung dịch thu được m gam chất rắn. m có giá trị là :
A. 6,88. B. 6,52. C. 7,24. D. 6,16.
(Đề thi thử Đại học lần 2 – THPT Chuyên Hùng Vương – Phú Thọ, năm học 2009 – 2010)
Câu 23: Đun nóng m gam hỗn hợp X gồm các chất có cùng một loại nhóm chức với 600 ml dung dịch NaOH 1,15M, thu được dung dịch Y chứa muối của một axit cacboxylic đơn chức và 15,4 gam hơi Z gồm các ancol. Cho toàn bộ Z tác dụng với Na dư, thu được 5,04 lít khí H2 (đktc). Cô cạn dung dịch Y, nung nóng chất rắn thu được với CaO cho đến khi phản ứng xảy ra hoàn toàn, thu được 7,2 gam một chất khí. Giá trị của m là
A. 40,60. B. 22,60. C. 34,30. D. 34,51.
(Đề thi tuyển sinh Đại học khối B năm 2012)
Câu 24: Cho X là hexapeptit Ala-Gly-Ala-Val-Gly-Val và Y là tetrapeptit Gly-Ala-Gly-Glu. Thủy phân hoàn toàn m gam hỗn hợp gồm X và Y thu được 4 amino axit, trong đó có 30 gam glyxin và 28,48 gam alanin. Giá trị của m là
A. 77,6. B. 83,2. C. 87,4. D. 73,4.
(Đề thi tuyển sinh Đại học khối A năm 2013)
Câu 25*: Cho V lít CO2 (đktc) hấp thụ hết trong dung dịch chứa 0,2 mol Ba(OH)2 và 0,1 mol NaOH. Sau phản ứng hoàn toàn thu kết tủa và dung dịch chứa 21,35 gam muối. Giá trị của V là :
A. 7,84. B. 8,96. C. 6,72. D. 7,84 hoặc 6,72.
Câu 26: Hòa tan hết m gam ZnSO4 vào nước được dung dịch X. Cho 110 ml dung dịch KOH 2M vào X, thu được a gam kết tủa. Mặt khác, nếu cho 140 ml dung dịch KOH 2M vào X thì cũng thu được a gam kết tủa. Giá trị của m là
A. 20,125. B. 12,375. C. 22,540. D. 17,710.
(Đề thi tuyển sinh Đại học khối A năm 2009)
Câu 27*: Cho 500 ml dung dịch Ba(OH)2 0,1M vào V ml dung dịch Al2(SO4)3 0,1M; sau khi các phản ứng kết thúc thu được 12,045 gam kết tủa. Giá trị của V là
A. 75. B. 150. C. 300. D. 200.
(Đề thi tuyển sinh Đại học khối A năm 2012)
Câu 28: Hòa tan 14 gam hỗn hợp Cu, Fe3O4 vào dung dịch HCl, sau phản ứng còn dư 2,16 gam hỗn hợp chất rắn và dung dịch X. Cho X tác dụng với AgNO3 dư thu được bao nhiêu gam kết tủa ?
A. 45,92. B. 12,96. C. 58,88. D. 47,4.
(Đề thi thử đại học lần 2 – THPT Chuyên Nguyễn Huệ – Hà Nội, năm học 2011 – 2012)
Câu 29: Cho 8,96 lít hỗn hợp 2 khí H2 và CO (đktc) đi qua ống sứ đựng 0,2 mol Al2O3 và 0,3 mol CuO nung nóng đến phản ứng hoàn toàn thu được chất rắn X. X phản ứng vừa đủ trong 0,5 lít dung dịch HNO3 có nồng độ aM (sản phẩm khử là khí NO duy nhất). Giá trị của a là
A. 2,00. B. 2,80. C. 3,67. D. 4,00.
(Đề thi thử đại học lần 4 – THPT Chuyên – Đại học Vinh, năm học 2010 – 2011)
Câu 30: Hòa tan hết 10,24 gam Cu bằng 200 ml dung dịch HNO3 3M được dung dịch A. Thêm 400 ml dung dịch NaOH 1M vào dung dịch A. Lọc bỏ kết tủa, cô cạn dung dịch rồi nung chất rắn đến khối lượng không đổi thu được 26,44 gam chất rắn. Số mol HNO3 đã phản ứng với Cu là :
A. 0,48 mol. B. 0,58 mol. C. 0,56 mol. D. 0,4 mol.
(Đề thi thử đại học lần 2 – THPT Chuyên Nguyễn Huệ – Hà Nội, năm học 2010 – 2011)
2. Bài tập chỉ có đáp án
Câu 31: Điện phân nóng chảy Al2O3 khi đó tại anot thoát ra một hỗn hợp khí gồm O2 10%; CO 20% và CO2 70%. Tổng thể tích khí là 6,72 m3 (tại nhiệt độ 819oC và áp suất 2,0 atm). Tính khối lượng Al thu được tại catot?
A. 2,16 kg. B. 5,40 kg. C. 4,86 kg. D. 4,32 kg.
(Đề thi thử Đại học lần 1 – THPT Chuyên Hùng Vương – Phú Thọ, năm học 2010 – 2011)
Câu 32: Cho m gam hỗn hợp Al, Fe vào 300 ml dung dịch HCl 1M và H2SO4 0,5M, thu được dung dịch X và 5,6 lít H2 (đktc). Tính thể tích dung dịch NaOH 1M cần cho vào dung dịch X để thu được kết tủa có khối lượng lớn nhất ?
A. 300 ml. B. 500 ml. C. 400 ml. D. 600 ml.
Câu 33: Cho 2,13 gam hỗn hợp X gồm ba kim loại Mg, Cu và Al ở dạng bột tác dụng hoàn toàn với oxi thu được hỗn hợp Y gồm các oxit có khối lượng 3,33 gam. Thể tích dung dịch HCl 2M vừa đủ để phản ứng hết với Y là :
A. 90 ml. B. 57 ml. C. 75 ml. D. 50 ml.
(Đề thi tuyển sinh Đại học khối A năm 2008)
Câu 34: Cho 20 gam hỗn hợp X gồm Fe, FeO, Fe3O4, Fe2O3 tan vừa hết trong 700 ml dung dịch HCl 1M thu được 3,36 lít H2 (đktc) và dung dịch D. Cho dung dịch D tác dụng với NaOH dư, lọc kết tủa và nung trong không khí đến khối lượng không đổi thu được chất rắn Y. Khối lượng Y là :
A. 16 gam. B. 32 gam. C. 8 gam. D. 24 gam.
Câu 35: Cho V lít dung dịch NaOH 2M vào dung dịch chứa 0,1 mol Al2(SO4)3 và 0,1 mol H2SO4 đến khi phản ứng hoàn toàn, thu được 7,8 gam kết tủa. Giá trị lớn nhất của V để thu được lượng kết tủa trên là :
A. 0,35. B. 0,25. C. 0,45. D. 0,05.
(Đề thi tuyển sinh Đại học khối A năm 2008)
Câu 36: Hỗn hợp Z gồm có Al và Al4C3. Nếu cho hỗn hợp Z tác dụng với H2O thu được 31,2 gam Al(OH)3. Nếu cho hỗn hợp Z tác dụng với dung dịch HCl, người ta thu được một muối duy nhất và 20,16 lít hỗn hợp khí (đktc). Khối lượng của Al và Al4C3 trong Z là :
A. 14,4 gam và 10,8 gam. B. 10,8 gam và 14,0 gam.
C. 10,8 gam và 14,4 gam. D. 5,4 gam và 7,2 gam.
(Đề thi thử Đại học lần 1 – THPT Chuyên Hùng Vương – Phú Thọ, năm học 2012 – 2013)
Câu 37: Hòa tan hết một lượng Na vào dung dịch HCl 10% thu được 46,88 gam dung dịch gồm NaCl và NaOH và 1,568 lít H2 (đktc). Nồng độ % NaCl trong dung dịch thu được là :
A. 14,97. B. 12,48. C. 12,68. D. 15,38.
Câu 38: Hòa tan m gam hỗn hợp gồm K và Ca vào nước thu được dung dịch A và 5,6 lít H2 (đktc). Hấp thụ 8,96 lít khí CO2 (đktc) vào dung dịch A thu được 10 gam kết tủa và dung dịch B. Cô cạn dung dịch B thu được 22,5 gam chất rắn khan gồm hai chất có cùng khối lượng mol. Giá trị của m là :
A. 12,85 gam. B. 16,75 gam. C. 10,85 gam. D. 14,80 gam.
Câu 39: Hấp thụ hoàn toàn 2,24 lít CO2 (đktc) vào 100 ml dung dịch gồm K2CO3 0,2M và KOH x mol/lít , sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cho toàn bộ Y tác dụng với dung dịch BaCl2 (dư), thu được 11,82 gam kết tủa. Giá trị của x là :
A. 1,0. B. 1,2. C. 1,4. D. 1,6.
(Đề thi tuyển sinh Đại học khối B năm 2011)
Câu 40: Cho 3,36 lít khí CO2 vào 200,0 ml dung dịch chứa NaOH xM và Na2CO3 0,4M thu được dung dịch X chứa 19,98 gam chất tan. Xác định nồng độ mol/l của NaOH trong dung dịch ?
A. 0,70M. B. 0,75M. C. 0,60M. D. 0,50M.
(Đề thi thử Đại học lần 1 – THPT Chuyên Hùng Vương – Phú Thọ, năm học 2010 – 2011)
Câu 41: Hấp thụ hết V lít khí CO2 (đktc) vào 300 ml dung dịch hỗn hợp chứa đồng thời Ba(OH)2 1M và KOH 1M, thu được 19,7 gam kết tủa và dung dịch X. Cho KOH dư vào dung dịch X lại thấy xuất hiện thêm m gam kết tủa nữa. Giá trị của V và m lần lượt là :
A. 17,92 và 39,4. B. 17,92 và 19,7. C. 17,92 và 137,9. D. 15,58 và 39,4.
(Đề thi thử đại học lần 1 – THPT Chuyên – Đại học Vinh, năm học 2011 – 2012)
Câu 42*: Cho m gam hỗn hợp X gồm Ba, BaO, Ba(OH)2 có cùng số mol vào nước thu được 500 ml dung dịch Y và V lít H2 (đktc). Hấp thụ 3,6V lít CO2 (đktc) vào 500 ml dung dịch Y thu được 37,824 gam kết tủa. Giá trị của m là :
A. 41,49 gam. B. 36,88 gam. C. 32,27 gam. D. 46,10 gam.
Câu 43*: Trong một cốc nước có hoà tan a mol Ca(HCO3)2 và b mol Mg(HCO3)2. Để làm mềm nước trong cốc cần dùng V lít nước vôi trong, nồng độ pM. Biểu thức liên hệ giữa V với a, b, p là :
A. V = (a +2b)/p. B. V = (a + b)/2p. C. V = (a + b)/p. D. V = (a + b)p.
Câu 44: Cho m gam Al4C3 phản ứng vừa hết với lượng dung dịch có 0,03 mol HCl, được dung dịch X. Mặt khác cho m’ gam Al4C3 kể trên phản ứng vừa hết với dung dịch có 0,04 mol KOH được dung dịch Y. Trộn lẫn toàn bộ X và Y kể trên với nhau được hỗn hợp Z chứa bao nhiêu mol muối nhôm ?
A. 0,025 mol. B. 0,01 mol. C. 0,04 mol. D. 0,08 mol.
(Đề thi thử Đại học lần 1 – THPT Chuyên Hùng Vương – Phú Thọ, năm học 2011 – 2012)
Câu 45*: Hoà tan hết m gam Al2(SO4)3 vào nước được dung dịch X. Cho 360 ml dung dịch NaOH 1M vào X, thu được 2a gam kết tủa. Mặc khác, nếu cho 400 ml dung dịch NaOH 1M vào X, cũng thu được a gam kết tủa. Các phản ứng xảy ra hoàn toàn, giá trị của m là:
A. 18,81. B. 15,39. C. 20,52. D. 19,665.
(Đề thi thử đại học lần 2 – THPT Chuyên Nguyễn Huệ – Hà Nội, năm học 2011 – 2012)
Câu 46*: Cho 240 ml dung dịch Ba(OH)2 1M vào 200 ml dung dịch hỗn hợp AlCl3 a mol/l và Al2(SO4)3 2a mol/l thu được 51,3 gam kết tủa. Giá trị của a là :
A. 0,12 . B. 0,16 . C. 0,15 . D. 0,2.
Câu 47*: Hòa tan 30 gam hỗn hợp gồm Al, Zn, Mg trong dung dịch HNO3 dư. Sau phản ứng thu được hỗn hợp khí gồm 0,1 mol NO, 0,1 mol N2O và dung dịch X. Cô cạn dung dịch X thu được 127 gam chất rắn. Số mol HNO3 đã tham gia phản ứng là bao nhiêu ?
A. 1,7. B. 1,4. C. 1,9. D. 1,8.
Câu 48: Đốt nóng một hỗn hợp gồm Al và 16 gam Fe2O3 (trong điều kiện không có không khí) đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn X. Cho X tác dụng vừa đủ với V ml dung dịch NaOH 1M sinh ra 3,36 lít H2 (đktc). Giá trị của V là :
A. 150. B. 100. C. 200. D. 300.
Câu 49: Hỗn hợp X gồm Fe, FeO, Fe2O3 và Fe3O4. Hoà tan hoàn toàn X trong 400 ml dung dịch HCl 2M thấy thoát ra 2,24 lít H2 và còn lại 2,8 gam sắt (duy nhất) chưa tan. Hãy cho biết nếu cho toàn bộ hỗn hợp X vào dung dịch HNO3 đặc, nóng dư thu được bao nhiêu lít khí NO2 ?
A. 4,48 lít. B. 10,08 lít. C. 16,8 lít. D. 20,16 lít.
Câu 50*: Hoà tan hoàn toàn một lượng hỗn hợp X gồm Fe3O4 và FeS2 trong 63 gam HNO3, thu được 1,568 lít NO2 (đktc). Dung dịch thu được cho tác dụng vừa đủ với 200 ml dung dịch NaOH 2M, lọc kết tủa đem nung đến khối lượng không đổi thu được 9,76 gam chất rắn. Nồng độ % của dung dịch HNO3 có giá trị là :
A. 47,2%. B. 46,2%. C. 46,6%. D. 44,2%.
(Đề thi HSG Tỉnh Thái Bình, năm học 2011 – 2012)
Câu 51: Khử hoàn toàn m gam FexOy bằng CO thu được 8,4 gam kim loại Fe và khí CO2. Hấp thụ hoàn toàn khí CO2 và 500 ml dung dịch Ba(OH)2 0,35M thì thu được kết tủa. Lọc kết tủa, cho dung dịch Na2SO4 dư vào dung dịch sau phản ứng thu được 5,825 gam kết tủa trắng. Công thức của oxit là :
A. FeO hoặc Fe2O3. B. Fe2O3 hoặc Fe3O4.
C. Fe3O4. D. FeO hoặc Fe3O4.
Câu 52: Cho 2,56 gam Cu vào bình chứa 25,2 gam dung dịch HNO3 60% đến khi phản ứng xảy ra hoàn toàn. Thêm tiếp 210 ml dung dịch KOH 1M vào bình. Phản ứng xong, cô cạn bình phản ứng, nung chất rắn thu được tới khối lượng không đổi được 20,76 gam chất rắn. Tính số mol HNO3 tham gia phản ứng hòa tan đồng.
A. 0,12 mol. B. 0,1 mol. C. 0,15 mol. D. 0,08 mol.
(Đề thi thử Đại học lần 1 – THPT Chuyên Hùng Vương – Phú Thọ, năm học 2011 – 2012)
Câu 53: Đốt cháy hoàn toàn một hợp chất hữu cơ X (C, H, N) bằng lượng không khí vừa đủ (gồm 1/5 thể tích O2, còn lại là N2) được khí CO2 , H2O và N2. Cho toàn bộ sản phẩm cháy qua bình đựng dung dịch Ba(OH)2 dư thấy có 39,4 gam kết tủa, khối lượng dung dịch giảm đi 24,3 gam. Khí thoát ra khỏi bình có thể tích 34,72 lít (đktc). Biết < 2. CTPT của X là :
A. C2H7N. B. C2H8N. C. C2H7N2. D. C2H4N2.
Câu 54: Đốt cháy hoàn toàn một hiđrocacbon A. Sản phẩm thu được hấp thụ hoàn toàn vào 200 ml dung dịch Ca(OH)2 0,2M thấy thu được 3 gam kết tủa. Lọc bỏ kết tủa, cân lại phần dung dịch thấy khối lượng tăng lên so với ban đầu là 0,28 gam. Hiđrocacbon trên có CTPT là :
A. C5H12. B. C2H6. C. C3H8 . D. C4H10.
Câu 55: Cho 400 ml một hỗn hợp gồm nitơ và một hiđrocacbon vào 900 ml oxi (dư) rồi đốt. Thể tích hỗn hợp thu được sau khi đốt là 1,4 lít. Sau khi cho nước ngưng tụ còn 800 ml hỗn hợp, người ta cho lội qua dung dịch KOH thấy còn 400 ml khí. Các thể tích khí đều đo ở cùng điều kiện nhiệt độ, áp suất. Công thức phân tử của chất hữu cơ là :
A. C3H8. B. C2H4. C. C2H2. D. C2H6.
Câu 56: Đốt cháy hoàn toàn một thể tích khí thiên nhiên gồm metan, etan, propan bằng oxi không khí (trong không khí, oxi chiếm 20% thể tích), thu được 7,84 lít khí CO2 (ở đktc) và 9,9 gam nước. Thể tích không khí (ở đktc) nhỏ nhất cần dùng để đốt cháy hoàn toàn lượng khí thiên nhiên trên là :
A. 70,0 lít. B. 78,4 lít. C. 84,0 lít. D. 56,0 lít.
Câu 57: Đốt cháy 2 gam hiđrocacbon A (khí trong điều kiện thường) được CO2 và 2 gam H2O. Mặt khác 2,7 gam A tác dụng với dung dịch AgNO3/NH3 dư được m gam kết tủa. Giá trị m là :
A. 8,05 gam. B. 7,35 gam. C. 16,1 gam. D. 24 gam.
Câu 58: Đun nóng m gam hỗn hợp X gồm C2H2, C2H4 và H2 với xúc tác Ni đến phản ứng xảy ra hoàn toàn, thu được 8,96 lít (đktc) hỗn hợp Y (có tỉ khối so với hiđro bằng 8). Đốt cháy hoàn toàn cùng lượng hỗn hợp X trên, rồi cho sản phẩm cháy hấp thụ hoàn toàn trong dung dịch nước vôi trong dư thì khối lượng kết tủa thu được là
A. 20 gam. B. 40 gam. C. 30 gam. D. 50 gam.
(Đề thi HSG Tỉnh Thái Bình, năm học 2009 – 2010)
Câu 59: Đốt cháy hoàn toàn 3 lít hỗn hợp X gồm 2 anken kế tiếp nhau trong dãy đồng đẳng cần vừa đủ 10,5 lít O2 (các thể tích khí đo trong cùng điều kiện nhiệt độ, áp suất). Hiđrat hóa hoàn toàn X trong điều kiện thích hợp thu được hỗn hợp ancol Y, trong đó khối lượng ancol bậc hai bằng 6/13 lần tổng khối lượng các ancol bậc một. Phần trăm khối lượng của ancol bậc một (có số nguyên tử cacbon lớn hơn) trong Y là
A. 46,43%. B. 31,58%. C. 10,88%. D. 7,89%.
(Đề thi tuyển sinh Đại học khối A năm 2012)
Câu 60: Đốt cháy hoàn toàn 0,1 mol anken X thu được CO2 và hơi nước. Hấp thụ hoàn toàn sản phẩm bằng 100 gam dung dịch NaOH 21,62% thu được dung dịch mới trong đó nồng độ của NaOH chỉ còn 5%. Công thức phân tử đúng của X là :
A. C2H4. B. C3H6. C. C4H8. D. C5H10.
Câu 61: Cho hỗn hợp A gồm 1 anken và 2 ankan là đồng đẳng liên tiếp vào một bình có dung tích 5,6 lít chứa O2 ở 0oC và 2 atm. Bật tia lửa điện để đốt cháy hết hiđrocacbon, sau đó đưa bình về 273oC thì áp suất trong bình là p. Nếu cho khí trong bình sau phản ứng lần lượt đi qua bình 1 đựng dung dịch H2SO4 đặc và bình 2 đựng dung dịch NaOH thấy khối lượng bình 1 tăng 3,6 gam, bình 2 tăng 7,92 gam. Tính p biết dung tích bình thay đổi không đáng kể.
A. 3,04. B. 4,8. C. 5,0. D. 5,2.
Câu 62: Đốt cháy hoàn toàn hỗn hợp gồm 0,1 mol etilenglicol và 0,2 mol ancol X cần dùng 0,95 mol khí oxi. Sau phản ứng thu được 0,8 mol khí CO2 và 1,1 mol H2O. Công thức phân tử của X là:
A. C3H6(OH)2. B. C3H5(OH)3. C. C3H5OH. D. C3H7OH.
(Đề thi thử Đại học lần 2 – THPT Chuyên Hùng Vương – Phú Thọ, năm học 2010 – 2011)
Câu 63: Cho hỗn hợp khí X gồm HCHO và H2 đi qua ống sứ đựng bột Ni nung nóng. Sau khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp Y gồm hai chất hữu cơ. Đốt cháy hết Y thì thu được 11,7 gam H2O và 7,84 lít khí CO2 (ở đktc). Phần trăm theo thể tích của H2 trong X là:
A. 65,00%. B. 46,15%. C. 35,00%. D. 53,85%.
(Đề thi tuyển sinh Đại học khối A năm 2009)
Câu 64: Cho a mol hỗn hợp X gồm HCHO, OHC – CHO và H2 đi qua ống đựng bột Ni nung nóng, sau một thời gian thu được hỗn hợp Y gồm khí và hơi. Đốt cháy hoàn toàn hỗn hợp Y, sinh ra 8,1 gam nước. Giá trị của a là :
A. 0,3. B. 0,25. C. 0,45. D. 0,5.
(Đề thi thử đại học lần 3 – THPT Chuyên – Đại học Vinh, năm học 2011 – 2012)
Câu 65: Đốt cháy hoàn toàn 1 mol hỗn hợp X gồm 1 ancol đơn chức và một anđehit đơn chức cần 76,16 lít O2 (đktc) tạo ra 54 gam H2O. Tỉ khối hơi của X đối với H2 là :
A. 32,4. B. 36,5. C. 28,9. D. 25,4.
Câu 66: Hỗn hợp X gồm axit fomic, axit acrylic, axit oxalic và axit axetic. Cho m gam X phản ứng hết với dung dịch NaHCO3 thu được 1,344 lít CO2 (đktc). Đốt cháy hoàn toàn m gam X cần 2,016 lít O2 (đktc), thu được 4,84 gam CO2 và a gam H2O. Giá trị của a là
A. 1,62. B. 1,80. C. 3,60. D. 1,44.
(Đề thi tuyển sinh Đại học khối A năm 2012)
Câu 67: Đốt cháy hoàn toàn 3,42 gam hỗn hợp gồm axit acrylic, vinyl axetat, metyl acrylat và axit oleic, rồi hấp thụ toàn bộ sản phẩm cháy vào dung dịch Ca(OH)2 (dư). Sau phản ứng thu được 18 gam kết tủa và dung dịch X. Khối lượng X so với khối lượng dung dịch Ca(OH)2 ban đầu đã thay đổi như thế nào ?
A. Tăng 2,70 gam. B. Giảm 7,74 gam. C. Tăng 7,92 gam. D. Giảm 7,38 gam.
(Đề thi tuyển sinh Đại học khối A năm 2011)
Câu 68: Hỗn hợp X gồm 1 mol aminoaxit no, mạch hở và 1 mol amin no, mạch hở. X có khả năng phản ứng tối đa với 2 mol HCl hoặc 2 mol NaOH. Đốt cháy hoàn toàn X thu được 6 mol CO2, x mol H2O và y mol N2. Các giá trị x, y tương ứng là
A. 8 và 1,0. B. 8 và 1,5. C. 7 và 1,0. D. 7 và 1,5.
(Đề thi tuyển sinh Đại học khối A năm 2010)
Câu 69*: Hỗn hợp X gồm 2 amino axit no (chỉ có nhóm chức –COOH và –NH2 trong phân tử), trong đó tỉ lệ Để tác dụng vừa đủ với 3,83 gam hỗn hợp X cần 30 ml dung dịch HCl 1M. Mặt khác, đốt cháy hoàn toàn 3,83 gam hỗn hợp X cần 3,192 lít O2 (đktc). Dẫn toàn bộ sản phẩm cháy (CO2, H2O và N2) vào nước vôi trong dư thì khối lượng kết tủa thu được là
A. 20 gam. B. 13 gam. C. 10 gam. D. 15 gam.
(Đề thi tuyển sinh Đại học khối A năm 2012)
Câu 70*: Tripeptit M và tetrapeptit Q đều được tạo ra từ một amino axit X mạch hở, phân tử có một nhóm -NH2. Phần trăm khối lượng của N trong X là 18,667%. Thuỷ phân không hoàn toàn m gam hỗn hợp M, Q (tỉ lệ mol 1 : 1) trong môi trường axit thu được 0,945 gam M; 4,62 gam đipeptit và 3,75 gam X. Giá trị của m là
A. 8,389. B. 58,725. C. 5,580. D. 9,315.
(Đề thi thử đại học lần 4 – THPT Chuyên – Đại học Vinh, năm học 2010 – 2011)
Phân tích và hướng dẫn giải
|
1A
|
2A
|
3D
|
4B
|
5C
|
6A
|
7D
|
8C
|
9A
|
10C
|
|
11A
|
12A
|
13D
|
14D
|
15C
|
16D
|
17A
|
18A
|
19B
|
20A
|
|
21D
|
22B
|
23A
|
24A
|
25A
|
26A
|
27B
|
28C
|
29D
|
30C
|
|
31C
|
32D
|
33C
|
34D
|
35C
|
36C
|
37A
|
38A
|
39C
|
40D
|
|
41A
|
42B
|
43A
|
44B
|
45A
|
46C
|
47C
|
48D
|
49C
|
50B
|
|
51D
|
52A
|
53A
|
54A
|
55D
|
56A
|
57A
|
58B
|
59D
|
60A
|
|
61B
|
62B
|
63B
|
64C
|
65D
|
66D
|
67D
|
68C
|
69B
|
70A
|
Mời các thầy cô và các em download file word tại đây
pp1-bao toan nguyen to
Xem thêm
Tổng hợp các chuyên đề hóa học lớp 10
Tổng hợp các chuyên đề hóa học lớp 11
Tổng hợp các chuyên đề hóa học lớp 12
Tổng hợp đề thi học kì 2 lớp 12 môn hóa học
Tổng hợp đề thi học kì 2 lớp 10 môn hoá học
Tổng hợp đề thi giữa học kì 2 cả ba khối 10 11 12
Tổng hợp đề thi THPT QG 2021 file word có lời giải chi tiết
Tổng hợp các phương pháp giải bài tập môn hoá học
Tổng hợp đề thi HSG lớp 12 môn hoá học
Phương pháp bảo toàn khối lượng đầy đủ
Phương pháp bảo toàn nguyên tố
Phương pháp bảo toàn khối lượng
Phương pháp quy đổi este
Phương pháp giải bài tập điện phân
Phương pháp đồng đẳng hoá