Phân dạng bài tập halogen

Xem thêm
Hệ thông câu hỏi trắc nghiệm halogen
Hệ thống câu hỏi trắc nghiệm oxi lưu huỳnh
Phân dạng bài tập oxi lưu huỳnh
PHÂN DẠNG BÀI TẬP VÀ VÍ DỤ MINH HỌA
Dạng 1: Bài toán về halogen tác dụng với kim loại
Phương pháp giải
+ Với F, Cl, Br phản ứng đưa kim loại lên số oxi hóa cao, còn với I phản ứng đưa kim loại lên số oxi hóa thấp hơn.
+ Phương trình phản ứng tổng quát:
2M + nX2 → 2MXn
+ Phương pháp giải: áp dụng định luật bảo toàn khối lượng, bảo toàn electron.
Bảo toàn khối lượng:
Bảo toàn electron:
PS : Các bài toán xây dựng dựa trên nhiều phản ứng oxi hóa khử, ta không nên giải theo phương pháp truyền thống mà nên ưu tiên phương pháp bảo toàn electron.
► Các ví dụ minh họa ◄
| Ví dụ 1: Thể tích khí Cl2 (đktc) cần dùng để oxi hóa hoàn toàn 7,8 gam kim loại Cr là
A. 3,36 lít. B. 1,68 lít. C. 5,04 lít. D. 2,52 lít.
(Đề thi thử THPT Quốc Gia lần 1 – Sở GD và ĐT Quảng Nam, năm 2016) |
| Ví dụ 2: Đốt cháy 11,9 gam hỗn hợp gồm Zn, Al trong khí Cl2 dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 40,3 gam hỗn hợp muối. Thể tích khí Cl2 (đktc) đã phản ứng là
A. 8,96 lít. B. 6,72 lít. C. 17,92 lít. D. 11,2 lít.
(Đề thi thử THPT Quốc Gia lần 2 – THPT Ngô Sĩ Liên – Bắc Giang, năm 2016) |
| Ví dụ 3: Cho 7,84 lít hỗn hợp khí X (đktc) gồm Cl2 và O2 phản ứng vừa đủ với 11,1 gam hỗn hợp Y gồm Mg và Al, thu được 30,1 gam hỗn hợp Z. Phần trăm khối lượng của Al trong Y là
A. 75,68%. B. 24,32%. C. 51,35%. D. 48,65%. |
Dạng 2: Bài toán halogen mạnh đẩy halogen yếu
Phương pháp giải
+ Các bài toán sẽ được xây dựng dựa trên 3 phương trình hóa học:
Cl2 + 2NaBr 2NaCl + Br2
Cl2 + 2NaI 2NaCl + I2
Br2 + 2NaI 2NaBr + I2
+ Sau phản ứng, một ion halogen này bị thay thế bởi một ion halogen khác. Nên ta có thể sử dụng phương pháp tăng giảm khối lượng để giải quyết bài toán.
► Các ví dụ minh họa ◄
| Ví dụ 4: Sục khí clo dư vào dung dịch chứa muối NaBr và KBr thu được muối NaCl và KCl, đồng thời thấy khối lượng muối giảm 4,45 gam. Thể tích khí clo đã tham gia phản ứng với 2 muối trên (đo ở đktc) là
A. 4,48 lít. B. 3,36 lít. C. 2,24 lít. D. 1,12 lít.
(Đề thi thử THPT Quốc Gia lần 2 – THPT Chuyên Hạ Long, năm 2016) |
| Ví dụ 5: Hỗn hợp X gồm NaBr và NaI. Cho hỗn hợp X tan trong nước thu được dung dịch A. Nếu cho brom dư vào dung dịch A, sau phản ứng hoàn toàn, cô cạn thấy khối lượng muối khan thu được giảm 7,05 gam. Nếu sục khí clo dư vào dung dịch A, phản ứng hoàn toàn, cô cạn dung dịch thấy khối lượng muối khan giảm 22,625 gam. Thành phần % khối lượng của một chất trong hỗn hợp X là:
A. 64,3%. B. 39,1%. C. 47,8%. D. 35,9% |
Dạng 3: Bài toán về phản ứng oxi hóa khử của axit HCl
- HCl tác dụng với kim loại
Phương pháp giải
+ Phương trình phản ứng tổng quát:
M + HCl MCln + H2
Trong đó: M là kim loại đứng trước H trong dãy hoạt động hóa học.
n là hóa trị thấp nhất của kim loại M.
+ Dãy hoạt động hóa học:
K Na Ca Ba Mg Al Zn Fe Ni Sb Pb H Cu Hg Ag Pt Au
+ Vận dụng định luật bảo toàn electron, định luật bảo toàn khối lượng để giải bài toán:
► Các ví dụ minh họa ◄
| Ví dụ 6: Hòa tan hoàn toàn 8,4 gam Fe vào dung dịch HCl dư, thu được dung dịch X và khí Y. Cô cạn dung dịch X thu được m gam muối khan. Giá trị của m là
A. 24,375. B. 19,05. C. 12,70. D. 16,25.
(Đề thi thử THPT Quốc Gia lần 1 – THPT Diễn Châu 2, năm 2016) |
| Ví dụ 7: Hòa tan hoàn toàn 7,8 gam hỗn hợp X gồm Al và Mg trong dung dịch HCl dư thu được 8,96 lít khí H2 (đktc) và dung dịch chức m gam muối. Giá trị của m là
A. 22,4. B. 28,4. C. 36,2. D. 22,0
(Đề thi thử THPT Quốc Gia lần 1 – THPT Chuyên Sư Phạm HN, năm 2016) |
| Ví dụ 8: Cho hỗn hợp gồm 5,4 gam Al và 5,6 gam Fe phản ứng hoàn toàn với lượng dư dung dịch HCl thu được V lít H2 (đktc). Giá trị của V là
A. 6,72. B. 10,08. C. 8,96. D. 11,2.
(Đề thi thử THPT Quốc Gia lần 1 – Sở GD và ĐT Nam Định, năm 2016) |
| Ví dụ 9: Cho 15 gam hỗn hợp bột kim loại Zn và Cu vào dung dịch HCl dư, sau khi phản ứng xảy ra hoàn toàn thu được 4,48 lít khí H2 và m gam chất rắn không tan. Giá trị của m là:
A. 6,4. B. 8,5. C. 2,2. D. 2,0.
(Đề thi thử THPT Quốc Gia lần 2 – THPT Lý Thái Tổ, năm 2016) |
| Ví dụ 10: Cho 12 gam hỗn hợp X gồm Al và Fe vào 100ml dung dịch HCl 2M đến phản ứng hoàn toàn thu được khí H2 và 7,0 gam chất rắn chưa tan. Thể tích dung dịch HCl 2M tối thiểu cần dung để hòa tan hết 12 gam hỗn hợp X là
A. 0,225 lít. B. 0,275 lít. C. 0,240 lít. D. 0,200 lít.
(Đề thi thử THPT Quốc Gia lần 1 – Sở GD và ĐT Nam Định, năm 2016) |
| Ví dụ 11: Hòa tan hoàn toàn 9,95 gam hỗn hợp X gồm Na, K và Ba vào 100 ml dung dịch HCl 1M thu được dung dịch Y và 2,24 lít khí H2 (đo ở đktc). Cô cạn dung dịch Y thu được m gam chất rắn. Giá trị của m là
A. 15,2. B. 13,5. C. 17,05. D. 11,65.
(Đề thi thử THPT Quốc Gia lần 2 – THPT Chuyên Hạ Long, năm 2016) |
- HCl tác dụng với chất oxi hóa mạnh
Phương pháp giải
+ Phản ứng giữa HCl và các chất oxi hóa mạnh như (MnO2, KMnO4, K2Cr2O7,…) là phản ứng oxi hóa khử, nên ta có thể áp dụng định luật bảo toàn electron để giải quyết nhanh gọn bài toán.
+ Cần nhớ số oxi hóa của các nguyên tố kim loại chính (Mn, Cr,…) trước và sau phản ứng để thuận tiện cho việc giải toán.
+ Định luật bảo toàn electron:
► Các ví dụ minh họa ◄
| Ví dụ 12: Hòa tan hoàn toàn 52,2 gam MnO2 trong dung dịch HCl đặc, nóng, dư thì sau phản ứng thu được bao nhiêu lít khí Cl2 ở đktc?
A. 11,2. B. 13,44. C. 8,96. D. 6,72.
(Đề thi thử THPT Quốc Gia lần 1 – THPT Yên Lạc 1, năm 2016) |
| Ví dụ 13: Cho 23,7 gam KMnO4 phản ứng hết với dung dịch HCl đặc (dư), thu được V lít khí Cl2 (đktc). Giá trị của V là
A. 6,72. B. 8,40. C. 3,36. D. 5,60. |
Dạng 4: Bài toán về HCl tác dụng với bazơ, oxit bazơ, muối
Phương pháp giải
+ Các phản ứng của HCl với bazơ, oxit bazơ, muối bản chất là phản ứng trao đổi nên có thể giải bài toán theo phương pháp tăng giảm khối lượng.
+ Oxit bazơ:
Nhìn vào phương trình phản ứng tổng quát trên ta thấy 2 nguyên tử clo đã thay thế 1 nguyên tử oxi nên ta có:
► Các ví dụ minh họa ◄
| Ví dụ 14: Để trung hoà 200 ml dung dịch NaOH 1,5M thì thể tích dung dịch HCl 0,5M cần dùng là bao nhiêu?
A. 0,5 lít. B. 0,4 lít. C. 0,3 lít. D. 0,6 lít. |
| Ví dụ 15: Cho 37,6 gam hỗn hợp gồm CaO, CuO và Fe2O3 tác dụng vừa đủ với 0,6 lít dung dịch HCl 2M, rồi cô cạn dung dịch sau phản ứng thì số gam muối khan thu được là
A. 80,2. B. 70,6. C. 49,3 D. 61,0. |
| Ví dụ 16: Hoà tan m gam hỗn hợp gồm KHCO3 và CaCO3 trong lượng dư dung dịch HCl. Sau khi các phản ứng xảy ra hoàn toàn, thu được 11,2 lít khí CO2 (đktc). Giá trị của m là
A. 60. B. 40. C. 50. D. 70.
(Đề thi thử THPT Quốc Gia lần 3 – THPT Lý Thái Tổ, năm 2016) |
Dạng 5: Phản ứng tạo kết tủa của halogen
Ví dụ 17: Cho lượng dư dung dịch AgNO3 vào dung dịch hỗn hợp gồm 0,1 mol NaF và 0,1 mol NaCl. Khối lượng kết tủa tạo thành là A. 14,35 g. B. 10,8 g. C. 21,6 g. D. 27,05 g. |
| Ví dụ 18: Cho 26,6 gam hỗn hợp KCl và NaCl hòa tan vào nước để được 500 gam dung dịch. Cho dung dịch trên tác dụng vừa đủ với AgNO3 thì thu được 57,4 gam kết tủa. Thành phần phần trăm theo khối lượng của KCl và NaCl trong hỗn hợp đầu là:
A. 56% và 44%. B. 60% và 40%.
C. 70% và 30%. D. 65% và 35%. |
| Ví dụ 19: Hoà tan hoàn toàn 24,4 gam hỗn hợp gồm FeCl2 và NaCl (có tỉ lệ số mol tương ứng là 1 : 2) vào một lượng nước (dư), thu được dung dịch X. Cho dung dịch AgNO3 (dư) vào dung dịch X, sau khi phản ứng xảy ra hoàn toàn sinh ra m gam chất rắn. Giá trị của m là:
A. 68,2. B. 28,7. C. 10,8. D. 57,4.
(Đề thi thử THPT Quốc Gia lần 1 – THPT Lương Ngọc Quyến, năm 2016) |
Dạng 6: Bài toán xác định nguyên tố kim loại, phi kim
| Ví dụ 20: Hoà tan hoàn toàn 8,45 gam một kim loại hoá trị II bằng dung dịch HCl. Cô cạn dung dịch sau phản ứng được 17,68 gam muối khan. Kim loại đã dùng là
A. Ba. B. Zn. C. Mg. D. Ca.
(Đề thi thử Quốc Gia lần 2 – Chuyên Thoại Ngọc Hầu, năm 2016) |
| Ví dụ 21: Cho 10,8 gam kim loại M tác dụng hoàn toàn với khí Cl2 dư thu được 53,4 gam muối clorua. Kim loại M là
A. Mg. B. Al. C. Fe. D. Zn.
(Đề thi thử THPT Quốc Gia lần 1 THPT Yên Định, năm 2016) |
| Ví dụ 22: Hoà tan hoàn toàn 3,80 gam hỗn hợp hai kim loại kiềm thuộc hai chu kì liên tiếp trong dung dịch HCl dư, thu được 2,24 lít khí H2 (đktc). Hai kim loại kiềm đó là
A. Li và Na. B. Na và K. C. Rb và Cs. D. K và Rb.
(Đề thi thử THPT Quốc Gia lần 2 – THPT Chuyên Sư Phạm HN, năm 2016) |
| Ví dụ 23: Cho 7,5 gam hỗn hợp X gồm kim loại M (hóa trị không đổi) và Mg (tỉ lệ mol tương ứng 2 : 3) tác dụng với 3,36 lít Cl2, thu được hỗn hợp rắn Y. Hòa tan hết toàn bộ Y trong lượng dư dung dịch HCl, thu được 1,12 lít H2. Biết các phản ứng đều xảy ra hoàn toàn, các thể tích khí đều đo ở đktc. Kim loại M là
A. Al. B. Na. C. Ca. D. K.
(Đề thi thử THPT Quốc Gia lần 1 – THPT Chuyên ĐH Vinh, năm 2015) |
|
| Ví dụ 24: Cho 1,37 gam hỗn hợp X gồm Fe và kim loại M hoá trị không đổi tác dụng với dung dịch HCl dư thấy giải phóng 1,232 lít khí H2 (đktc). Mặt khác hỗn hợp X trên tác dụng vừa đủ với lượng khí Cl2 điều chế được bằng cách cho 3,792 gam KMnO4 tác dụng với dung dịch HCl đặc dư. Tỉ lệ số mol của Fe và M trong hỗn hợp là 1: 3. Kim loại M là
A. Mg. B. Cu. C. Al. D. Zn.
(Đề thi thử THPT Quốc Gia lần 2 – THPT Chuyên Sư Phạm HN, năm 2016) |
|
| Ví dụ 25: Cho 31,84 gam hỗn hợp NaX và NaY (X, Y là 2 nguyên tố halogen ở 2 chu kì liên tiếp) vào dung dịch AgNO3 dư thì thu được 57,34g kết tủa. Công thức của hai muối là
A. NaBr và NaI. B. NaF và NaCl.
C. NaCl và NaBr. D. NaF, NaCl hoặc NaBr, NaI. |
|
Dạng 7: Bài toán về hiệu suất phản ứng
Phương pháp giải
+ Tính hiệu suất theo chất tham gia:
+ Tính hiệu suất theo sản phẩm:
+ Nếu bài toán gồm nhiều quá trình:
Lưu ý: tính hiệu suất theo chất thiếu. Có thể tính trực tiếp ở dạng thể tích, khối lượng.
► Các ví dụ minh họa ◄
| Ví dụ 26: Cho 3 lít Cl2 phản ứng với 2 lít H2; hiệu suất phản ứng đạt 80%. Phần trăm thể tích Cl2 trong hỗn hợp khí sau phản ứng là (các thể tích khí được đo ở cùng điều kiện t0, p)
A. 28%. B. 64%. C. 60%. D. 8%. |
| Ví dụ 27: Khối lượng natri và thể tích khí clo ở điều kiện tiêu chuẩn cần để điều chế 9,36 gam muối NaCl là (biết H = 80%)
A. 3,68 gam và 2,24 lít. B. 3,68 gam và 1,792 lít.
C. 4,6 gam và 1,792 lít. D. 4,6 gam và 2,24 lít. |
Dạng 8: Bài toán tổng hợp
| Ví dụ 28: Cho m gam X gồm Fe, FeO, Fe3O4, Fe2O3 vào 400 ml dung dịch HCl 2M, sau phản ứng thu được 2,24 lít H2 (ở đktc), dung dịch Y, và 2,8 gam Fe không tan. Giá trị m là
A. 27,2. B. 30,0. C. 25,2. D. 22,4.
(Đề thi thử THPT Quốc Gia lần 2 – THPT Hàn Thuyên, năm 2016) |
| Ví dụ 29: Hỗn hợp X gồm Zn , Mg và Fe. Hòa tan hết 23,40 gam hỗn hợp X vào dung dịch HCl thu được 11,20 lít khí (đktc). Để tác dụng với vừa hết 23,40 gam hỗn hợp X cần 12,32 lít khí Clo (đktc). Khối lượng của Fe trong hỗn hợp là
A. 8,4 g. B. 11,2 g. C. 2,8 g. D. 5,6 g.
(Đề thi thử THPT Quốc Gia lần 2 – THPT Chuyên KHTN – HN, năm 2016) |
| Ví dụ 30: Đốt 6,16 gam Fe trong 2,24 lít (đktc) hỗn hợp khí X gồm Cl2 và O2, thu được 12,09 gam hỗn hợp Y chỉ gồm oxit và muối clorua (không còn khí dư). Hòa tan Y bằng dung dịch HCl (vừa đủ), thu được dung dịch Z. Cho AgNO3 dư vào Z, thu được m gam kết tủa. Giá trị của m là
A. 27,65. B. 37,31. C. 44,87. D. 36,26.
(Đề thi thử THPT Quốc Gia lần 1 – THPT Chuyên Tuyên Quang, năm 2016) |
D. HỆ THỐNG BÀI TẬP VÀ HƯỚNG DẪN GIẢI
Dạng 1: Bài toán về halogen tác dụng với kim loại
Câu 1: Để chuyển 11,2 gam Fe thành FeCl3 thì thể tích khí clo (đktc) cần dùng là
- 8,96 lít. B. 3,36 lít. C. 6,72 lít. D. 2,24 lít.
(Đề thi thử THPT Quốc Gia lần 1 – THPT Triệu Sơn, năm 2016)
Câu 2: Cho 5,4 gam Al tác dụng hết với khí Cl2 (dư), thu được m gam muối. Giá trị của m là
- 12,5. B. 25,0. C. 19,6. D. 26,7.
(Đề thi thử THPT Quốc Gia lần 1 – THPT Lê Xoay, năm 2016)
Câu 3: Đốt cháy hoàn toàn m gam Fe trong khí Cl2 dư, thu được 6,5 gam muối. Giá trị của m là
- 2,24. B. 2,80. C. 1,12. D. 0,56.
(Đề thi thử THPT Quốc Gia lần 1 – THPT Lý Thường Kiệt, năm 2016)
Câu 4: Đun nóng Na với Cl2 thu được 11,7 gam muối. Khối lượng Na và thể tích khí clo (đktc) đã phản ứng là:
- 4,6gam; 2,24 lít. B. 2,3gam; 2,24 lít.
- 4,6gam; 4,48lít. D. 2,3gam; 4,48 lít.
Câu 5: Đốt cháy hết 13,6g hỗn hợp Mg, Fe trong bình khí clo dư, sau phản ứng thấy thể tích khí clo giảm 8,96 lít. Khối lượng muối clorua khan thu được là
- 65,0 g. B. 38,0 g. C. 50,8 g. D. 42,0 g.
Câu 6: Để cháy hoàn toàn hỗn hợp X gồm 3,84 gam Mg và 4,32 gam Al cần 5,824 lít hỗn hợp khí Y (đktc) gồm O2 và Cl2. Tính % thể tích Cl2 trong hỗn hợp Y?
- 46,15%. B. 56,36%. C. 43,64%. D. 53,85%.
Dạng 2: Bài toán halogen mạnh đẩy halogen yếu
Câu 7: Hòa tan toàn 13,76 gam hỗn hợp X gồm hai muối NaCl và NaBr vào nước thu được dung hoàn dịch X. Cho khí clo lội từ từ cho đến dư qua dung dịch X thu được dung dịch Y. Làm bay hơi dung dịch Y cho tới khi thu được 12,87 gam muối khan B. Khối lượng của NaCl trong hỗn hợp X là
- 11,7. B. 5,85. C. 8,77. D. 9,3.
Câu 8: Hòa tan hoàn toàn x gam hỗn hợp gồm NaI và NaBr vào nước thu được dung dịch X . Cho Br2 dư vào X được dung dịch Y. Cô cạn dung dịch thu được y gam chất rắn khan.Hòa tan y gam chất rắn khan đó vào nước thu được dung dịch Z. Cho Cl2 dư vào dung dịch Z thu được dung dịch T. Cô cạn T thu được z gam chất rắn khan. Biết các phản ứng xảy ra hoàn toàn và 2y = x + z. Phần trăm khối lượng của NaBr trong hỗn hợp đầu là
- 5,4%. B. 4,5%. C. 3,7%. D. 7,3%.
(Đề thi thử THPT Quốc Gia lần 1 – THPT Chuyên Quốc Học – Huế, năm 2016)
Dạng 3: Bài toán về phản ứng oxi hóa khử của axit HCl
- HCl tác dụng với kim loại
Câu 9: Hòa tan m gam Fe bằng dung dịch HCl vừa đủ thu được dung dịch Y. Cô cạn dung dịch Y thu được 25,4 gam muối khan. Vậy giá trị của m là
- 16,8 gam. B. 11,2 gam. C. 6,5 gam. D. 5,6 gam.
(Đề thi thử THPT Quốc Gia lần 1 – THPT Hàn Thuyên, năm 2016)
Câu 10: Cho m gam hỗn hợp Zn, Fe tác dụng với vừa đủ với 73 gam dung dịch HCl
10%. Cô cạn dung dịch thu được 13,15 g muối. Giá trị m là
- A. 7,05. 5,3. C. 4,3. D. 6,05.
Câu 11: Hòa tan hoàn toàn 20 gam hỗn hợp Mg và Fe bằng dung dịch HCl dư. Sau phản ứng thu được 11,2 lít khí (đktc) và dung dịch X. Cô cạn dung dịch X thì thu được bao nhiêu gam muối khan?
- 55,5 g. B. 91,0 g. C. 90,0 g. D. 71,0 g.
(Đề thi thử THPT Quốc Gia lần 1 – THPT Phụ Dực – Thái Bình, năm 2016)
Câu 12: Cho 6,05 gam hỗn hợp X gồm Fe và Zn phản ứng hoàn toàn với dung dịch HCl loãng (dư), thu được 0,1 mol khí H2. Khối lượng của Fe trong 6,05 gam X là
- 1,12 g. B. 2,80 g. C. 4,75 g. D. 5,60 g.
(Đề thi thử THPT Quốc Gia lần 1 – Sở GD và ĐT Bắc Giang, năm 2016)
Câu 13: Hoà tan 7,8 gam hỗn hợp bột Al và Mg trong dung dịch HCl dư. Sau phản ứng khối lượng dung dịch tăng thêm 7,0 gam so với dung dịch HCl ban đầu. Khối lượng Al và Mg trong hỗn hợp đầu là
- 5,8 gam và 3,6 gam. B. 1,2 gam và 2,4 gam.
- 5,4 gam và 2,4 gam. D. 2,7 gam và 1,2 gam.
(Đề thi thử THPT Quốc Gia lần 1 – THPT Quỳnh Lưu 1, năm 2016)
Câu 14: Cho 17,6 gam hỗn hợp X gồm Fe và Cu phản ứng với dung dịch HCl loãng (dư), đến khi phản ứng xảy ra hoàn toàn thu được 4,48 lít khí H2 (đktc) và dung dịch chứa m gam muối. Giá trị của m là?
- 25,4 g. B. 31,8 g. C. 24,7 g. D. 18,3 g.
(Đề thi thử THPT Quốc Gia lần 3 – THPT Quỳnh Lưu 1, năm 2016)
Câu 15: Hòa tan 9,14 gam hỗn hợp Cu, Mg, Al bằng dung dịch HCl vừa đủ thu được 7,84 lít khí X (đktc); dung dịch Z và 2,54 gam chất rắn Y. Lọc bỏ chất rắn Y , cô cạn dung dịch Z thu được khối lượng muối khan là
- 19,025 g. B. 31,45 g. C. 33,99 g. D. 56,3 g.
Câu 16: Cho 18,6 gam hỗn hợp Fe và Zn vào 500 ml dung dịch HCl x mol/l. Sau phản ứng hoàn toàn cô cạn được 34,575 gam chất rắn. Nếu cho hỗn hợp trên tác dụng với 800 ml dung dịch HCl x mol/l cô cạn thu được 39,9 gam chất rắn. Giá trị của x và khối lượng của Fe trong hỗn hợp là:
- x = 0,9 và 5,6 gam. B. x = 0,9 và 8,4 gam.
- x = 0,45 và 5,6 gam. D. x = 0,45 và 8,4 gam.
(Đề thi thử THPT Quốc Gia lần 1 – THPT Phụ Dực, năm 2016)
Câu 17: Hoà tan hoàn toàn 28,4 gam hỗn hợp 3 kim loại hoá trị I và II bằng dung dịch HCl thu được dung dịch A và V lít khí (đktc). Cô cạn dung dịch A thu được 49,7 gam hỗn hợp muối khan. V có giá trị là?
- 8,96. B. 5,6. C. 6,72. D. 3,36.
(Đề thi thử THPT Quốc Gia lần 1 – THPT Lương Thế Vinh – HN, năm 2016)
- HCl Tác dụng với chất oxi hóa mạnh
Câu 18: Cho lượng dư MnO2 vào 25ml dung dịch HCl 8M. Thể tích khí Cl2 sinh ra (đktc) là
- 1,34 lít. B. 1,45 lít. C. 1,12 lít. D. 1,4 lít.
Câu 19: Muốn điều chế được 3,36 lít khí Cl2 (đktc) thì khối lượng K2Cr2O7 tối thiểu cần lấy để cho tác dụng với dung dịch HCl đặc, dư là
- 13,2 g. B. 13,7 g. C. 14,2 g. D. 14,7 g.
(Đề thi thử THPT Quốc Gia lần 1 – THPT Lê Lợi – Thanh Hóa, năm 2016)
Dạng 4: Bài toán về HCl tác dụng với bazơ, oxit bazơ, muối
Câu 20: Để trung hòa 20 ml dung dịch HCl 0,1M cần 10 ml dung dịch NaOH nồng độ x mol/l. Giá trị của x là
- A. 0,3. B. 0,4. C. 0,2. D. 0,1.
Câu 21: Khi cho 100ml dung dịch KOH 1M vào 100ml dung dịch HCl thì phản ứng xảy ra vừa đủ. Nồng độ mol của HCl trong dung dịch đã dùng là
- 1,0M. B. 0,25M. C. 0,5M. D. 0,75M.
(Đề thi thử THPT Quốc Gia lần 1 – THPT Ngô Gia Tự – Vĩnh Phúc, năm 2016)
Câu 22: Cần dùng 300 gam dung dịch HCl 3,65% để hòa tan vừa hết x gam Al2O3. Giá trị của x là
- 51. B. 5,1. C. 153. D. 15,3.
Câu 23: Đốt cháy hoàn toàn 5,8 gam hỗn hợp gồm Zn và Mg trong không khí thu được hỗn hợp oxit X. Hòa tan hết X trong dung dịch HCl 1M. Thể tích dung dịch axit hòa tan hết được X là :
- 250 ml. B. 500 ml. C. 100 ml. D. 150 ml.
(Đề thi thử THPT Quốc Gia lần 1 – THPT Chuyên Quốc Học – Huế, năm 2016)
Câu 24: Đốt cháy hỗn hợp X gồm 3 kim loại Mg, Zn, Cu thu được 34,5 gam hỗn hợp rắn Y gồm các oxit kim loại. Để hòa tan hết hỗn hợp Y cần dùng vừa đủ dung dịch chứa 0,8 mol HCl. Khối lượng hỗn hợp X là
- 31,3 g. B. 24,9 g. C. 21,7 g. D. 28,1 g.
(Đề thi thử THPT Quốc Gia lần 2 – THPT Nguyễn Trãi – Thanh Hóa, năm 2016)
Câu 25: Cho 2,7 gam hỗn hợp X gồm Al, Fe và Mg phản ứng hết với O2 dư thu được 4,14 gam hỗn hợp Y gồm 3 oxit. Cho Y phản ứng vừa đủ với V lít dung dịch HCl 0,3M. Giá trị của V là
- 0,30. B. 0,15. C. 0,60. D. 0,12.
(Đề thi thử THPT Quốc Gia lần 2 – THPT Chuyên Tuyên Quang, năm 2016)
Câu 26: Cho 4,5 g hỗn hợp M gồm Na, Ca và Mg tác dụng hết với O2 dư thu được 6,9 gam hỗn hợp Y gồm các oxit. Cho Y phản ứng vừa đủ với V lít dung dịch HCl 1M. Giá trị của V là
- 0,15. B. 0,12. C. 0,60. D. 0,30.
(Đề thi thử THPT Quốc Gia lần 1 – THPT Trực Ninh, năm 2016)
Câu 27: Cho hỗn hợp 2 muối MgCO3 và CaCO3 tan trong dung dịch HCl vừa đủ tạo ra 2,24 lít khí (đktc). Số mol của 2 muối cacbonat ban đầu là
- 0,15 mol. B. 0,2 mol. C. 0,1 mol. D. 0,3 mol.
Câu 28: Cho 50 gam CaCO3 tác dụng vừa đủ với dung dịch HCl 20% (d=1,2g/ml). Khối lượng dung dịch HCl đã dùng là
- 152,08 g. B. 55,0 g. C. 180,0 g. D. 182,5 g.
(Đề thi thử THPT Quốc Gia lần 2 – THPT Lý Thái Tổ, năm 2016)
Câu 29: Hòa tan hoàn toàn 20,6 gam hỗn hợp gồm Na2CO3 và CaCO3 bằng dung dịch HCl dư, thu được V lít khí CO2 (đktc) và dung dịch chứa 22,8 gam hỗn hợp muối. Giá trị của V là
- 2,24. B. 4,48. C. 1,79. D. 5,6.
(Đề thi thử THPT Quốc Gia lần 1 – THPT Trần Phú – Vĩnh Phúc, năm 2016)
Dạng 5: Phản ứng tạo kết tủa của halogen
Câu 30: Cho dung dịch BaCl2 có dư tác dụng với dung dịch AgNO3 2M thu được 28,7 gam kết tủa. Thể tích dung dịch AgNO3 đã dùng là
- 150 ml. B. 80 ml. C. 200 ml. D. 100 ml.
Câu 31: Cho 200 ml dung dịch AgNO3 0,4M tác dụng với 300 ml dung dịch FeCl2 0,1M. Kết thúc phản ứng thu được m gam kết tủa. Giá trị của m là:
- 10,045. B. 10,77. C. 8,61. D. 11,85.
Câu 32: Đốt 13,0 gam Zn trong bình chứa 0,15 mol khí Cl2, sau phản ứng hoàn toàn thu được chất rắn X. Cho X vào dung dịch AgNO3 dư thì thu được lượng kết tủa là?
- 46,30 g. B. 57,10 g. C. 53,85 g. D. 43,05 g.
(Đề thi thử THPT Quốc Gia lần 1 – THPT Chuyên Bến Tre, năm 2016)
Dạng 6: Bài toán xác định nguyên tố kim loại, phi kim
Câu 33: Cho 0,3 gam một kim loại hóa trị II phản ứng hết với dung dịch HCl dư, thu được 0,28 lít H2 (đktc). Kim loại đó là?
- Ba B. Ca. C. Mg. D. Sr.
(Đề thi thử THPT Quốc Gia lần 1 – THPT Chuyên Lam Sơn, năm 2016)
Câu 34: Cho 26,5 gam M2CO3 tác dụng với một lượng dư dung dịch HCl. Sau phản ứng thu được 5,6 lít khí (ở đktc). Kim loại M là
- Na. B. K. C. Li. D. Rb.
(Đề thi thử THPT Quốc Gia lần 2 – THPT Nam Phù Cừ, năm 2016)
Câu 35: Đốt 3,36 gam kim loại M trong khí quyển clo thì thu được 9,75 gam muối clorua. Kim loại M là
- Cu. B. Zn. C. Fe. D. Al.
(Đề thi thử THPT Quốc Gia lần 1 – THPT Chuyên Hạ Long, năm 2016)
Câu 36: Cho 8,8 gam một hỗn hợp gồm hai kim loại kiềm thổ ở hai chu kì liên tiếp tác dụng với dung dịch HCl dư thu được 6,72 lít khí H2 (ở đktc). Hai kim loại đó là
- Ca và Sr. B. Be và Mg. C. Mg và Ca. D. Sr và Ba.
(Đề thi thử THPT Quốc Gia lần 1 – THPT Thanh Oai A, năm 2016)
Câu 37: Hòa tan hoàn toàn 2,45g hỗn hợp X gồm hai kim loại kiềm thổ vào 200 ml dung dịch HCl 1,25M thu được dung dịch Y chứa các chất tan có nồng độ mol bằng nhau. Hai kim loại kiềm thổ đó là
- Be và Ca. B. Mg và Ca.
- Be và Mg. D. Mg và Sr.
(Đề thi thửTHPT Quốc Gia lần 1 – THPT Trực Ninh, năm 2016)
Câu 38: Chất A là muối Canxi halogenua. Dung dịch chứa 0,200 gam A tác dụng với lượng dư dung dịch bạc nitrat thì thu được 0,376 gam kết tủa bạc halogenua. Công thức phân tử của chất A là
- A. CaF2. CaCl2. C. CaBr2. D. CaI2.
Câu 39: Cho 0,03 mol hỗn hợp NaX và NaY ( X, Y là hai halogen thuộc chu kì kế tiếp ) tác dụng với lượng dư dung dịch AgNO3 thu được 4,75 gam kết tủa. Công thức hai muối trên là:
- NaBr, NaI. B. NaF, NaCl.
- NaCl, NaBr. D. NaF, NaCl hoặc NaBr, NaI.
Câu 40: Cho dung dịch chứa 24,12 gam hỗn hợp gồm hai muối NaX và NaY (X, Y là hai nguyên tố có trong tự nhiên, ở hai chu kì liên tiếp thuộc nhóm VIIA, số hiệu nguyên tử ZX < ZY) vào dung dịch AgNO3 (dư), thu được 34,44 gam kết tủa. Phần trăm số mol của NaX trong hỗn hợp ban đầu là
- 60%. B. 40%. C. 66,67%. D. 50%.
Câu 41: Hỗn hợp X gồm Al và kim loại M (trong đó số mol M lớn hơn số mol của Al). Hòa tan hoàn toàn 1,08 gam hỗn hợp X bằng 100 ml dung dịch HCl thu được 0,0525 mol khí H2 và dung dịch Y. Cho dung dịch Y tác dụng với dung dịch AgNO3 dư thu được 17,9375 gam chất rắn. Biết M có hóa trị II trong muối tạo thành, nhận xét nào sau đây đúng?
- Nồng độ dung dịch HCl đã dùng là 1,05M.
- Kim loại M là sắt.
- Thành phần % về khối lượng của mỗi kim loại trong X là 50%.
- Số mol kim loại M là 0,025 mol.
(Đề thi thử THPT Quốc Gia lần 2 – THPT Chuyên Phan Bội Châu, năm 2016)
Dạng 7: Bài toán về hiệu suất phản ứng
Câu 42: Nung 17,55 gam NaCl với H2SO4 đặc, dư thu được bao nhiêu lít khí ở điều kiện tiêu chuẩn (biết hiệu suất của phản ứng là H= 90%)?
- 0,672 lít. B. 6,72 lít. C. 6,048 lít. D. 5,6 lít.
Câu 43: Cho 2 lít (đktc) H2 tác dụng với 1,344 lít Cl2 (đktc) rồi hòa tan sản phẩm vào nước để được 40 gam dụng dịch A. Lấy 10 gam A tác dụng với dung dịch AgNO3 dư thu được 3,444 gam kết tủa. Tính hiệu suất phản ứng giữa H2 và Cl2 (giả sử Cl2 và H2 không tan trong nước)?
- 20%. B. 80%. C. 40%. C. 50%.
Câu 44: Khối lượng thuốc tím và HCl cần dùng để điều chế 4,48 lít khí clo là (biết H = 80%)
- 12,64 gam và 23,36 gam. B. 15,8 gam và 29,2 gam.
- 12,64 gam và 14,6 gam. C. 15,8 và 18,25 gam.
Dạng 8: Bài toán tổng hợp
Câu 45: Trong tự nhiên Clo có hai đồng vị bền chiếm 24,23% tổng số nguyên tử ,còn lại là . Thành phần % theo khối lượng của trong HClO4 là
- 8,92%. B. 8,43%. C. 8,56%. D. 8,79%
(Đề thi thử THPT Quốc Gia lần 1 – THPT Kim Liên, năm 2016)
Câu 46: Hỗn hợp X gồm Mg, MgO, Ca và CaO. Hòa tan 10,72 gam X vào dung dịch HCl vừa đủ thu được 3,248 lít khí (đktc) và dung dịch Y. Trong Y có 12,35 gam MgCl2 và m gam CaCl2. Giá trị m là
- 33,3. B. 15,54. C. 13,32. D. 19,98.
(Đề thi thử THPT Quốc Gia lần 3 – THPT Trung Nghĩa – Phú Thọ, năm 2016)
Câu 47: Cho 19,02 gam hỗn hợp Mg, Ca, CaO, MgO, MgCO3, CaCO3 tác dụng với dung dịch HCl vừa đủ thu được 4,704 lít hỗn hợp khí (đktc) có tỉ khối so với H2 là 12,5 và dung dịch chứa 12,825 gam MgCl2 và m gam CaCl2. Giá trị của m là
- 18,78. B. 19,425. C. 20,535. D. 19,98.
(Đề thi thử THPT Quốc Gia lần 2 – THPT Chuyên Phan Bội Châu, năm 2016)
Câu 48: Cho 20,4 gam hỗn hợp X gồm Al , Zn và Fe tác dụng với dung dịch HCl dư thu được 10,08 lít H2. Mặt khác 0,2 mol hỗn hợp X tác dụng vừa đủ với 6,16 lít Cl2. Tính thành phần % về khối lượng của Al trong hỗn hợp X ( biết khí thu được đều đo ở đktc)
- 33,09%. B. 26,47%. C. 19,85%. D. 13,24%.
(Đề thi thử THPT Quốc Gia lần 1 – THPT Chuyên Sư Phạm HN, năm 2016)
Câu 49: Cho m gam hỗn hợp X gồm Fe, Al, Cr tác dụng hết với lượng dư khí Cl2, thu được (m + 31,95) gam muối. Mặt khác, cũng cho m gam X tan hết trong dung dịch HCl dư, thu được 7,84 lít khí H2 (đktc). Phần trăm số mol của Al trong X là
- 33,33%. B. 75,00%. C. 25,00%. D. 66,67%.
(Đề thi thử THPT Quốc Gia lần 1 – Sở GD và ĐT Bắc Giang, năm 2016)
Câu 50: Cho 53,75 gam hỗn hợp X gồm kim loại Sn, Fe, Al tác dụng vừa đủ với 25,20 lít khí Cl2 (đktc). Mặt khác khi cho 0,40 mol hỗn hợp X tác dụng với dung dịch HCl nóng, dư thu được 9,92 lít khí H2 (đktc). Biết các phản ứng xảy ra hoàn toàn. Khối lượng của kim loại Al trong 0,40 mol hỗn hợp X là
- 1,54. B. 4,05. C. 2,31. D. 3,86.
Câu 51: Đốt cháy hỗn hợp gồm 1,92 gam Mg và 4,48 gam Fe với khí X gồm O2 và Cl2 sau phản ứng chỉ thu được hỗn hợp Y gồm các oxit và muối clorua (không còn khí dư). Hòa tan Y bằng một lượng vừa đủ 120 ml dung dịch HCl 2M, thu được dung dịch Z. Cho AgNO3 dư vào dung dịch Z thu được 56,69 gam kết tủa. Tính % thể tích clo trong hỗn hợp X?
- 76,7%. B. 56,36%. C. 51,72%. D. 53,85%.
(Đề thi thử THPT Quốc Gia lần 3 – THPT Lý Thái Tổ, năm 2016)
Câu 52: Đốt cháy hỗn hợp gồm 0,02 mol Mg và 0,03 mol Fe với hỗn hợp khí X gồm clo và oxi, sau phản ứng chỉ thu được 4,77 gam hỗn hợp Y gồm các oxit và muối clorua (không còn khí dư). Hòa tan hết Y bằng 150 ml dung dịch HCl 0,2M, thu được dung dịch Z. Cho dung dịch AgNO3 loãng dư vào dung dịch Z thu được 13,995 gam kết tủa. Phần trăm thể tích của oxi trong hỗn hợp X là
- 37,89 %. B. 33,33%. C. 38,79 %. D. 44,44 %.
(Đề thi thử THPT Quốc Gia lần 1 – THPT Chuyên Quốc Học – Huế, năm 2016)
Link download bản pdf đầy đủ phân dạng bài tập halogen không có đáp án
Phân dạng bài tập halogen – không có đáp án
Link download bản pdf đầy đủ phân dạng bài tập halogen có đáp án
Phân dạng bài tập halogen – có đáp án
Xem thêm
Hệ thông câu hỏi trắc nghiệm halogen
Hệ thống câu hỏi trắc nghiệm oxi lưu huỳnh
Phân dạng bài tập oxi lưu huỳnh














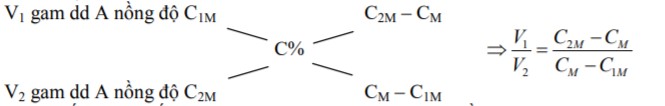
 Trộn V1 lít dd A nồng độ C1M với V2 lít dd A nồng độ C2M thu được (V1+V2) lít dd A nồng độ CM. (với C1M < CM < C2M)
Trộn V1 lít dd A nồng độ C1M với V2 lít dd A nồng độ C2M thu được (V1+V2) lít dd A nồng độ CM. (với C1M < CM < C2M)