Giáo án môn hoá học lớp 12 học kì 2
CHỦ ĐỀ 5: ĐẠI CƯƠNG VỀ KIM LOẠI
CHỦ ĐỀ 5 – TIẾT 1: VỊ TRÍ CỦA KIM LOẠI TRONG BẢNG TUẦN HOÀN
VÀ CẤU TẠO CỦA KIM LOẠI
Kiến thức cũ có liên quan: cấu hình electron nguyên tử, mối quan hệ giữa vị trí và cấu hình electron
- MỤC TIÊU:
- Kiến thức: HS biết:
– Vị trí của kim loại trong bảng tuần hoàn.
– Cấu tạo của nguyên tử kim loại và cấu tạo tinh thể của các kim loại.
– Liên kết kim loại.
- Kĩ năng: Rèn luyện kĩ năng từ vị trí của kim loại suy ra cấu tạo và tính chất, từ tính chất suy ra ứng dụng và phương pháp điều chế.
- Thái độ: Kích thích sự hứng thú với bộ môn, phát huy khả năng tư duy của học sinh
- TRỌNG TÂM:
– Từ vị trí của kim loại suy ra cấu tạo và tính chất, từ tính chất suy ra ứng dụng và phương pháp điều chế.
III. CHUẨN BỊ:
– Bảng tuần hoàn các nguyên tố hoá học.
– Bảng phụ vẽ sơ đồ cấu tạo nguyên tử (có ghi bán kính nguyên tử) của các nguyên tố thuộc chu kì 2.
– Tranh vẽ 3 kiểu mạng tinh thể và mô hình tinh thể kim loại (mạng tinh thể lục phương, lập phương tâm diện, lập phương tâm khối).
- PHƯƠNG PHÁP: Nêu vấn đề + đàm thoại + hoạt động nhóm.
- TIẾN TRÌNH BÀY DẠY:
- Ổn định lớp: Chào hỏi, kiểm diện.
- Kiểm tra bài cũ: Viết cấu hình electron nguyên tử của các nguyên tố 11Na, 20Ca, 13Al. Xác định số electron ở lớp ngoài cùng và cho biết đó là nguyên tố kim loại hay phi kim ?
- Bài mới:
| HOẠT ĐỘNG CỦA THẦY VÀ TRÒ | NỘI DUNG | ||||||||||||||
| Hoạt động 1
– GV dùng bảng tuần hoàn và yêu cầu HS xác định vị trí của các nguyên tố kim loại trong bảng tuần hoàn. – GV gợi ý để HS tự rút ra kết luận về vị trí của các nguyên tố kim loại trong bảng tuần hoàn.
Hoạt động 2 – GV yêu cầu HS viết cấu hình electron của các nguyên tố kim loại: Na, Mg, Al và các nguyên tố phi kim P, S, Cl. So sánh số electron ở lớp ngoài cùng của các nguyên tử kim loại và phi kim trên. Nhận xét và rút ra kết luận. – GV dùng bảng phụ vẽ sơ đồ cấu tạo nguyên tử của các nguyên tố thuộc chu kì 2 và yêu cầu HS rút ra nhận xét về sự biến thiên của điện tích hạt nhân và bán kính nguyên tử.
Hoạt động 3 – GV thông báo về cấu tạo của đơn chất kim loại. – GV dùng mô hình thông báo 3 kiểu mạng tinh thể của kim loại. – HS nhận xét về sự khác nhau của 3 kiểu mạng tinh thể trên.
Hoạt động 4 – GV thông báo về liên kết kim loại và yêu cầu HS so sánh liên kết kim loại với liên kết cộng hoá trị và liên kết ion.
|
I. VỊ TRÍ CỦA KIM LOẠI TRONG BẢNG TUẦN HOÀN
– Nhóm IA (trừ H), nhóm IIA (trừ B) và một phần của các nhóm IVA, VA, VIA. – Các nhóm B (từ IB đến VIIIB). – Họ lantan và actini.
II. CẤU TẠO CỦA KIM LOẠI 1. Cấu tạo nguyên tử – Nguyên tử của hầu hết các nguyên tố kim loại đều có ít electron ở lớp ngoài cùng (1, 2 hoặc 3e). Thí dụ: Na: [Ne]3s1 Mg: [Ne]3s2 Al: [Ne]3s23p1 – Trong chu kì, nguyên tử của nguyên tố kim loại có bán kính nguyên tử lớn hơn và điện tích hạt nhân nhỏ hơn so với các nguyên tử của nguyên tố phi kim. Thí dụ:
2. Cấu tạo tinh thể – Ở nhiệt độ thường, trừ Hg ở thể lỏng, còn các kim loại khác ở thể rắn và có cấu tạo tinh thể. – Trong tinh thể kim loại, nguyên tử và ion kim loại nằm ở những nút của mạng tinh thể. Các electron hoá trị liên kết yếu với hạt nhân nên dễ tách khỏi nguyên tử và chuyển động tự do trong mạng tinh thể. a) Mạng tinh thể lục phương – Các nguyên tử, ion kim loại nằm trên các đỉnh và tâm các mặt của hình lục giác đứng và ba nguyên tử, ion nằm phía trong của hình lục giác. – Trong tinh thể, thể tích của các nguyên tử và ion kim loại chiếm 74%, còn lại 26% là không gian trống. Ví dụ: Be, Mg, Zn. b) Mạng tinh thể lập phương tâm diện – Các nguyên tử, ion kim loại nằm trên các đỉnh và tâm các mặt của hình lập phương. – Trong tinh thể, thể tích của các nguyên tử và ion kim loại chiếm 74%, còn lại 26% là không gian trống. Ví dụ: Cu, Ag, Au, Al,… c) Mạng tinh thể lập phương tâm khối – Các nguyên tử,ion kim loại nằm trên các đỉnh và tâm của hình lập phương. – Trong tinh thể, thể tích của các nguyên tử và ion kim loại chiếm 68%, còn lại 32% là không gian trống. Ví dụ: Li, Na, K, V, Mo,… 3. Liên kết kim loại Liên kết kim loại là liên kết được hình thành giữa các nguyên tử và ion kim loại trong mạng tinh thể do có sự tham gia của các electron tự do. |
- CỦNG CỐ:
- GV treo bảng tuàn hoàn và yêu cầu HS xác định vị trí của 22 nguyên tố phi kim. Từ đó thấy phần còn lại của bảng tuần hoàn là gồm các nguyên tố kim loại.
- Phân biệt cấu tạo của nguyên tử kim loại và cấu tạo của đơn chất kim loại để thấy trong đơn chất, kim loại có liên kết kim loại.
- DẶN DÒ
- Bài tập về nhà: 1 → 9 trang 82 (SGK).
- Xem trước bài phần TÍNH CHẤT CỦA KIM LOẠI
VII. RÚT KINH NGHIỆM
…………………………………………………………………………………………………………………………………..
…………………………………………………………………………………………………………………………………..
…………………………………………………………………………………………………………………………………..
Ngày
Tổ trưởng kí duyệt
Nguyễn Thị Hương
CHỦ ĐỀ 5: ĐẠI CƯƠNG VỀ KIM LOẠI
CHỦ ĐỀ 5 – TIẾT 2: TÍNH CHẤT CỦA KIM LOẠI DÃY ĐIỆN HOÁ CỦA KIM LOẠI (Tiết 1)
Kiến thức cũ có liên quan: Cấu tạo của kim loại, dãy hoạt động hóa học của kim loại
- MỤC TIÊU:
- Kiến thức:
– HS biết: Tính chất vật lí chung của kim loại.
– HS hiểu: Nguyên nhân gây nên những tính chất vật lí chung của kim loại.
- Kĩ năng: Giải thích được nguyên nhân gây nên một số tính chất vật lí chung của kim loại.
- Thái độ: Giải thích được một số hiện tượng trong đời sống
- TRỌNG TÂM:
– Nguyên nhân gây nên những tính chất vật lí chung của kim loại.
III. CHUẨN BỊ:
- PHƯƠNG PHÁP: Nêu vấn đề + đàm thoại + hoạt động nhóm.
- TIẾN TRÌNH BÀY DẠY:
- Ổn định lớp: Chào hỏi, kiểm diện.
- Kiểm tra bài cũ: Liên kết kim loại là gì ? So sánh liên kết kim loại với liên kết cộng hoá trị và liên kết ion.
- Bài mới:
| HOẠT ĐỘNG CỦA THẦY VÀ TRÒ | NỘI DUNG |
| Hoạt động 1
– GV yêu cầu HS nêu những tính chất vật lí chung của kim loại (đã học ở năm lớp 9).
Hoạt động 2 – HS nghiên cứu SGK và giải thích tính dẻo của kim loại. – GV ?: Nhiều ứng dụng quan trọng của kim loại trong cuộc sống là nhờ vào tính dẻo của kim loại. Em hãy kể tên những ứng dụng đó.
Hoạt động 3 – HS nghiên cứu SGK và giải thích nguyên nhân về tính dẫn điện của kim loại. – GV dẫn dắt HS giải thích nguyên nhân vì sao ở nhiệt độ cao thì độ dẫn điện của kim loại càng giảm.
Hoạt động 4 – HS nghiên cứu SGK và giải thích nguyên nhân về tính dẫn nhiệt của kim loại.
Hoạt động 5 – HS nghiên cứu SGK và giải thích nguyên nhân về tính ánh kim của kim loại. – GV giới thiệu thêm một số tính chất vật lí khác của kim loại. |
I. TÍNH CHẤT VẬT LÍ
1. Tính chất chung: Ở điều kiện thường, các kim loại đều ở trạng thái rắn (trừ Hg), có tính dẻo, dẫn điện, dẫn nhiệt và có ánh kim.
2. Giải thích a) Tính dẻo Kim loại có tính dẻo là vì các ion dương trong mạng tinh thể kim loại có thể trượt lên nhau dễ dàng mà không tách rời nhau nhờ những electron tự do chuyển động dính kết chúng với nhau.
b) Tính dẫn điện – Khi đặt một hiệu điện thế vào hai đầu dây kim loại, những electron chuyển động tự do trong kim loại sẽ chuyển động thành dòng có hướng từ cực âm đến cực dương, tạo thành dòng điện. – Ở nhiệt độ càng cao thì tính dẫn điện của kim loại càng giảm do ở nhiệt độ cao, các ion dương dao động mạnh cản trở dòng electron chuyển động.
c) Tính dẫn nhiệt – Các electron trong vùng nhiệt độ cao có động năng lớn, chuyển động hỗn loạn và nhanh chóng sang vùng có nhiệt độ thấp hơn, truyền năng lượng cho các ion dương ở vùng này nên nhiệt độ lan truyền được từ vùng này đến vùng khác trong khối kim loại. – Thường các kim loại dẫn điện tốt cũng dẫn nhiệt tốt.
d) Ánh kim Các electron tự do trong tinh thể kim loại phản xạ hầu hết những tia sáng nhìn thấy được, do đó kim loại có vẻ sáng lấp lánh gọi là ánh kim. Kết luận: Tính chất vật lí chung của kim loại gây nên bởi sự có mặt của các electron tự do trong mạng tinh thể kim loại. – Không những các electron tự do trong tinh thể kim loại, mà đặc điểm cấu trúc mạng tinh thể kim loại, bán kính nguyên tử,…cũng ảnh hưởng đến tính chất vật lí của kim loại. * Ngoài một số tính chất vật lí chung của các kim loại, kim loại còn có một số tính chất vật lí không giống nhau. – Khối lượng riêng: Nhỏ nhất: Li (0,5g/cm3); lớn nhất Os (22,6g/cm3). – Nhiệt độ nóng chảy: Thấp nhất: Hg (−390C); cao nhất W (34100C). – Tính cứng: Kim loại mềm nhất là K, Rb, Cs (dùng dao cắt được) và cứng nhất là Cr (có thể cắt được kính).
|
- CỦNG CỐ
- Nguyên nhân gây nên những tính chất vật lí chung của kim loại ? Giải thích.
- Em hãy kể tên các vật dụng trong gia đình được làm bằng kim loại. Những ứng dụng của các đồ vật đó dựa trên tính chất vật lí nào của kim loại ?
- DẶN DÒ
- Bài tập về nhà: 1, 8 trang 88 (SGK).
- Xem trước phần TÍNH CHẤT HOÁ HỌC CHUNG CỦA KIM LOẠI
VII. RÚT KINH NGHIỆM
…………………………………………………………………………………………………………………………………..
…………………………………………………………………………………………………………………………………..
…………………………………………………………………………………………………………………………………..
Ngày
Tổ trưởng kí duyệt
Mời các thầy cô download file đầy đủ tại đây
Xem thêm
Tổng hợp các chuyên đề hóa học lớp 10
Tổng hợp các chuyên đề hóa học lớp 11
Tổng hợp các chuyên đề hóa học lớp 12
Giáo án môn hoá học lớp 10 học kì 1
Giáo án môn hoá học lớp 10 học kì 2
Giáo án môn hoá học lớp 11 học kì 1
Giáo án môn hoá học lớp 11 học kì 2
Giáo án môn hoá học lớp 12 học kì 1
Giáo án môn hoá học lớp 12 học kì 2









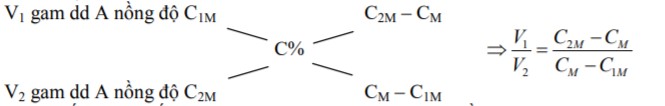
 Trộn V1 lít dd A nồng độ C1M với V2 lít dd A nồng độ C2M thu được (V1+V2) lít dd A nồng độ CM. (với C1M < CM < C2M)
Trộn V1 lít dd A nồng độ C1M với V2 lít dd A nồng độ C2M thu được (V1+V2) lít dd A nồng độ CM. (với C1M < CM < C2M)