Câu hỏi trắc nghiệm oxi lưu huỳnh

HỆ THỐNG CÂU HỎI TRẮC NGHIỆM THEO CÁC CẤP ĐỘ
1. Mức độ nhận biết
Câu 1: Cấu hình electron lớp ngoài cùng của các nguyên tử các nguyên tố nhóm VIA là
- ns2np4. B. ns2np5. C. ns2np3. D. ns2np6.
Câu 2: Trong nhóm oxi, đi từ oxi đến telu. Phát biểu nào sau đây sai?
- Bán kính nguyên tử tăng dần.
- Độ âm điện của các nguyên tử giảm dần.
- Tính bền của các hợp chất với hiđro tăng dần.
- Tính axit của các hợp chất hiđroxit giảm dần.
Câu 3: Vị trí của nguyên tố Oxi trong bảng tuần hoàn hóa học là
- Ô thứ 8, chu kì 3, nhóm VIA. B. Ô thứ 8, chu kì 2, nhóm VIA.
- Ô thứ 16, chu kì 3, nhóm VIA. D. Ô thứ 16, chu kì 2, nhóm VIA.
Câu 4: Ion X2- có cấu hình electron lớp ngoài cùng là 2s22p6. X là nguyên tố nào sau đây?
- Oxi. B. Lưu huỳnh. C. Clo. D. Flo.
Câu 5: Nguyên tử nguyên tố X có tổng số electron ở các phân lớp p là 10. Nguyên tố X là
- Na. B. Cl. C. O. D. S.
Câu 6: Một nguyên tử X có tổng số electron ở các phân lớp p là 10. Nguyên tố X thuộc loại
- Nguyên tố p. B. Nguyên tố f.
- Nguyên tố s. D. Nguyên tố d.
(Đề thi thử THPT chuyên Hà Giang – Lần 2 – 2015)
Câu 7: Nguyên tố lưu huỳnh có Z = 16. Công thức oxit cao nhất của lưu huỳnh là
- S2O5. B. SO4. C. SO2. D. SO3.
Câu 8: Số oxi hóa có thể có của lưu huỳnh trong hợp chất là
- 0, 2, 4, 6. B. -2, 0, +4, +6.
- 1, 3, 5, 7. D. -2, +4, +6.
Câu 9: Số oxi hoá của lưu huỳnh trong một loại hợp chất oleum H2S2O7 là
- -2. B. +4. C. +6. D. +8.
Câu 10: Phản ứng không xảy ra là
- 2Mg + O2 2MgO.
- C2H5OH + 3O2 2CO2 + 3H2O.
- 2Cl2 + 7O2 2Cl2O7.
- 4P + 5O2 2P2O5.
Câu 11: Các khí có thể cùng tồn tại trong một hỗn hợp là
- NH3 và HCl. B. H2S và Cl2.
- Cl2 và O2. D. H2S và O2.
Câu 12: Chất nào sau đây không phản ứng với O2 là
- SO3. B. P. C. Ca. D. C2H5OH.
Câu 13: Oxi tác dụng với tất cả các chất trong nhóm nào dưới đây?
- Mg, Cl2. B. Al, N2. C. Ca, F2. D. Au, S.
Câu 14: Đơn chất vừa có tính oxi hóa vừa có tính khử là
- F2. B. O3. C. S. D. O2.
Câu 15: Câu nào sau đây đúng khi nói về tính chất hoá học của lưu huỳnh?
- Lưu huỳnh không có tính oxi hoá, tính khử.
- Lưu huỳnh chỉ có tính oxi hoá.
- Lưu huỳnh có tính oxi hoá và tính khử.
- Lưu huỳnh chỉ có tính khử.
Câu 16: Dãy gồm các chất đều tác dụng (trong điều kiện phản ứng thích hợp) với lưu huỳnh là
- Hg, O2, HCl. B. Pt, Cl2, KClO3.
- Zn, O2, F2. D. Na, Br2, H2SO4 loãng.
Câu 17: Kim loại nào sau đây tác dụng với lưu huỳnh ở nhiệt độ thường?
- Al. B. Fe. C. Hg. D. Cu.
Câu 18: Hiđro sunfua (H2S) là chất có
- Tính axit mạnh. B. Tính oxi hóa mạnh.
- Vừa có tính axit, vừa có tính bazơ. D. Tính khử mạnh.
Câu 19: Cho FeS tác dụng với dung dịch HCl, khí bay ra là
- H2S. B. Cl2. C. SO2. D. H2.
Câu 20: Trong điều kiện thường, dung dịch H2S tiếp xúc với oxi của không khí, dung dịch dần chuyển sang màu gì?
- Tím. B. Nâu. C. Xanh nhạt. D. Vàng.
Câu 21: Lưu huỳnh trong chất nào sau đây chỉ có tính khử?
- H2S. B. SO2. C. Na2S2O3. D. H2SO4.
(Đề thi thử THPT Quỳnh Lưu 1 – Nghệ An – Lần 2 – 2016)
Câu 22: Trong hợp chất nào sau đây nguyên tố S chỉ có tính khử?
- Na2SO4. B. SO2. C. H2S. D. H2SO4.
Câu 23: Dãy nào sau đây đều có tính oxi hoá và khử?
- O2; S; SO2. B. S; SO2 ; Cl2.
- O3; H2S; SO2. D. H2SO4; S; Cl2.
Câu 24: Lưu huỳnh trong chất nào sau đây vừa có tính oxi hóa, vừa có tính khử?
- SO2. B. Na2SO4. C. H2S. D. H2SO4.
(Đề thi thử THPT Đô Lương 1 – Nghệ An – Lần 2 – 2016)
Câu 25: Cho phản ứng hóa học: S + H2SO4 đặc X + H2O. Vậy X là chất nào sau đây?
- SO2. B. H2S. C. H2SO3. D. SO3.
Câu 26: Muốn pha loãng dung dịch axit H2SO4 đặc cần làm như sau:
- Rót từ từ dung dịch axit đặc vào nước.
- Rót từ từ nước vào dung dịch axit đặc.
- Rót nhanh dung dịch axit đặc vào nước.
- Rót thật nhanh nước vào dung dịch axit đặc.
Câu 27: Để pha loãng H2SO4 đặc cách làm nào sau đây đúng?
- cách 1. B. cách 2.
- cách 3. D. cách 1 và 2.
Câu 28: Oleum có công thức tổng quát là
- H2SO4.nSO2. B.H2SO4.nH2O. C. H2SO4.nSO3. D.H2SO4 đặc.
Câu 29: Dung dịch H2SO4 loãng phản ứng được với tất cả các kim loại thuộc dãy nào sau đây?
- Cu, Na. B. Ag, Zn. C. Mg, Al. D. Au, Pt.
Câu 30: Axit H2SO4 loãng tác dụng với Fe tạo thành sản phẩm:
- Fe2(SO4)3 và H2. B. FeSO4 và H2.
- FeSO4 và SO2. D. Fe2(SO4)3 và SO2.
Câu 31: Dung dịch axit sunfuric loãng tác dụng được với 2 chất trong dãy nào sau đây?
- S và H2S. B. Fe và Fe(OH)3. C. Cu và Cu(OH)2. D. C và CO2.
Câu 32: Dãy gồm tất cả các chất đều tác dụng với dung dịch H2SO4 loãng là:
- Fe3O4, BaCl2, NaCl, Al, Cu(OH)2.
- Fe(OH)2, Na2CO3, Fe, CuO, NH3.
- CaCO3, Cu, Al(OH)3, MgO, Zn.
- Zn(OH)2, CaCO3, CuS, Al, Fe2O3.
Câu 33: Người ta nung nóng Cu với dung dịch H2SO4 đặc, nóng. Khí sinh ra có tên gọi là
- Khí oxi. B. Khí hyđro.
- Khí cacbonic. D. Khí sunfurơ.
Câu 34: Các khí sinh ra trong thí nghiệm phản ứng của saccarozơ (C12H22O11) với dung dịch H2SO4 đặc bao gồm:
- H2S và CO2. B. H2S và SO2.
- SO3 và CO2. D. SO2 và CO2.
Câu 35: Trường hợp nào sau đây có phản ứng?
- H2SO4 loãng + Cu. B. H2SO4 loãng + S.
- H2SO4 đặc, nguội + Al. D. H2SO4 đặc + Na2CO3.
Câu 36: Nhóm kim loại nào sau đây không tác dụng với H2SO4 loãng?
- Zn, Al. B. Na, Mg. C. Cu, Hg. D. Mg, Fe.
Câu 37: Nhóm gồm tất cả các kim loại tan trong dung dịch H2SO4 đặc nóng nhưng không tan trong dung dịch H2SO4 loãng là:
- Hg, Ag, Cu. B. Al, Fe, Cr.
- Ag, Fe, Pt. D. Al, Cu, Au.
Câu 38: Trong các phản ứng sau đây, ở phản ứng nào axit H2SO4 là axit loãng?
- 2H2SO4 + C → 2SO2 + CO2 + 2H2O.
- H2SO4 + 2Na → Na2SO4 + H2.
- 2H2SO4 + S → 3SO2 + 2H2O.
- 6H2SO4 + 2Fe → Fe2(SO4)3 + 3SO2 + 6H2O.
Câu 39: Trong các phản ứng sau đây, phản ứng nào axit H2SO4 là axit đặc?
- H2SO4 + Na2CO3 → Na2SO4 + CO2 + H2O.
- H2SO4 + Ca → CaSO4 + H2.
- 2H2SO4 + Cu → CuSO4 + 2H2O + SO2.
- 3H2SO4 + 2Al → Al2(SO4)3 + 3H2.
Câu 40: H2SO4 đặc, nguội không tác dụng được với tất cả các kim loại thuộc nhóm nào?
- Al, Mg, Fe. B. Fe, Al, Cr.
- Ag, Cu, Au. D. Ag, Cu, Fe.
Câu 41: Dãy chất nào sau đây gồm những chất đều tác dụng được với dung dịch H2SO4 loãng?
- Cu, ZnO, NaOH, CaOCl2. B. CuO, Fe(OH)2, Al, NaCl.
- Mg, ZnO, Ba(OH)2, CaCO3. D. Na, CaCO3, Mg(OH)2, BaSO4.
Câu 42: H2SO4 đặc nóng không tác dụng với chất nào sau đây?
- Fe. B. NaCl rắn. C. Ag. D. Au.
Câu 43: Dãy chất nào sau đây phản ứng được với dung dịch axit sunfuric đặc nguội?
- Au, C. B. Mg, Fe. C. Zn, NaOH. D. Al, S.
Câu 44: Axit sufuric đặc, nguội có thể đựng trong bình chứa làm bằng
- Cu. B. Ag. C. Ca. D. Al.
2. Mức độ thông hiểu
Câu 45: Hạt vi mô nào dưới đây có cấu hình electron giống Ar?
- O2-. B. S. C. Te. D. S2-.
Câu 46: Khác với nguyên tử S, ion S2- có:
- Bán kính ion nhỏ hơn và ít electron hơn.
- Bán kính ion nhỏ hơn, nhiều electron hơn.
- Bán kính ion lớn hơn và ít electron hơn.
- Bán kính ion lớn hơn, nhiều electron hơn.
Câu 47: Khí nào sau đây có thể thu được bằng phương pháp dời chỗ nước?
- O2. B. HCl. C. H2S. D. SO2.
Câu 48: Cho các khí sau: O2, O3, N2, H2. Chất khí tan nhiều trong nước nhất là
- O2. B. O3. C. N2. D. H2.
Câu 49: Ở điều kiện thường, để so sánh tính oxi hóa của ozon mạnh hơn oxi ta có thể dùng
- Ag. B. Hg. C. S. D. Mg
Câu 50: Hãy chọn phát biểu đúng về oxi và ozon:
- Oxi và ozon đều có tính oxi hoá mạnh như nhau.
- Oxi và ozon đều có số proton và số notron giống nhau trong phân tử.
- Oxi và ozon là các dạng thù hình của nguyên tố oxi.
- Oxi và ozon đều phản ứng được với các chất như: Ag, KI, PbS ở nhiệt độ thường.
Câu 51: Trong những câu sau, câu nào sai khi nói về tính chất hóa học của ozon?
- Ozon oxi hóa tất cả các kim loại.
- Ozon oxi hóa Ag thành Ag2O.
- Ozon kém bền hơn oxi.
- Ozon oxi hóa ion I– thành I2.
Câu 52: Chọn phát biểu không đúng khi nói về lưu huỳnh?
- lưu huỳnh phản ứng trực tiếp với hiđro ở điều kiện thường.
- ở trạng thái rắn, mỗi phân tử lưu huỳnh có 8 nguyên tử.
- lưu huỳnh tác dụng được hầu hết với các phi kim.
- trong các phản ứng với hiđro và kim loại lưu huỳnh là chất oxi hoá.
Câu 53: Chọn phát biểu đúng:
- Ở nhiệt độ thường, phân tử lưu huỳnh gồm có 1 nguyên tử.
- Hai dạng thù hình của nguyên tử lưu huỳnh: Sα và Sβ khác nhau về cấu tạo tinh thể và tính chất hóa học.
- Lưu huỳnh tà phương (Sα) bền ở nhiệt độ thường.
- Một trong những ứng dụng của lưu huỳnh là dùng để khử chua đất phèn.
Câu 54: Phản ứng nào sau đây lưu huỳnh đóng vai trò là chất oxi hóa?
- S + O2 SO2.
- S + 2Na Na2S.
- S + 2H2SO4 (đ) 3SO2 + 2H2O.
- S + 6HNO3 (đ) H2SO4 + 6NO2 + 2H2O.
(Đề thi thử THPT Quỳnh Lưu 1 – Nghệ An – Lần 3 – 2016)
Câu 55: Cho các phản ứng hóa học sau:
(a) S + O2 SO2 (b) S + 3F2 SF6
(c) S + 6HNO3 H2SO4 + 6NO2 + 2H2O (d) S + Hg HgS
Số phản ứng trong đó S thể hiện tính khử là
- 2. B. 3. C. 1. D. 4.
(Đề tuyển sinh Cao đẳng – năm 2014)
Câu 56: Nguyên tử S đóng vai trò vừa là chất khử, vừa là chất oxi hoá trong phản ứng nào sau đây?
- 4S + 6NaOH2Na2S + Na2S2O3 + 3H2O.
- S + 2Na Na2S.
- S + 6HNO3 đặc H2SO4 + 6NO2 + 4H2O.
- S + 3F2 SF6.
Câu 57: Đưa mảnh giấy lọc tẩm dung dịch KI và hồ tinh bột vào bình đựng khí ozon, hiện tượng gì xuất hiện trên giấy lọc?
- màu xanh đậm. B. màu đỏ.
- màu vàng. D. Không hiện tượng.
Câu 58: Để phân biệt oxi và ozon có thể dùng chất nào sau đây?
- Cu. B. Hồ tinh bột.
- H2. D. Dung dịch KI và hồ tinh bột.
Câu 59: Khi cho ozon tác dụng lên giấy tẩm dung dịch KI và hồ tinh bột, thấy xuất hiện tượng màu xanh. Hiện tượng này xảy ra là do sự oxi hoá
- tinh bột. B. ozon. C. kali. D. iotua.
Câu 60: Trong nhiệt kế chứa thủy ngân rất độc. Khi nhiệt kế bị vỡ người ta thường dùng chất nào sau đây để thu hồi thủy ngân là tốt nhất?
- Cát. B. Lưu huỳnh. C. Than. D. Muối ăn.
(Đề thi thử THPT Chuyên Phan Bội Châu – Nghệ An – 2015)
Câu 61: Phản ứng nào sau đây không chứng minh được H2S có tính khử?
- H2S + 4Cl2 + 4H2O ® H2SO4 + 8HCl.
- H2S + 2NaOH ® Na2S + 2H2O.
- 2H2S + 3O2 ® 2H2O + 2SO2.
- 2H2S + O2 ® 2H2O + 2S.
Câu 62: Phản ứng nào sau đây, H2S đóng vai trò chất khử?
- 2H2S + 4Ag + O2 2Ag2S+ 2H2O.
- H2S + Pb(NO3)22HNO3 + PbS.
- 2Na + 2H2S2NaHS + H2.
- 3H2S + 2KMnO4 2MnO2 + 2KOH + 3S+ 2H2O.
Câu 63: Phản ứng nào sau đây không xảy ra?
- H2S + Pb(NO3)2 PbS+ 2HNO3.
- CuS + 2HClH2S + CuCl2.
- Na2S + Pb(NO3)2 PbS+ 2NaNO3.
- FeS + HClH2S + FeCl2.
Câu 64: Trường hợp không xảy ra phản ứng hóa học là
- 3O2 + 2H2S ® 2H2O + 2SO2.
- FeCl2 + H2S ® FeS + 2HCl.
- O3 + 2KI + H2O ® 2KOH + I2+ O2.
- Cl2 + 2NaOH ® NaCl + NaClO + H2O.
Câu 65: Cho phản ứng hoá học: H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl. Vai trò của H2S trong phản ứng là
- Chất khử. B. Môi trường.
- Chất oxi hóa. D. Vừa oxi hóa, vừa khử.
Câu 66: Dung dịch H2S không phản ứng với chất hoặc dung dịch nào sau đây ở điều kiện thường?
- khí O2. B. dung dịch CuSO4. C. dung dịch FeSO4. D. khí Cl2.
(Đề thi thử THPT Diễn Châu 2 – Nghệ An – 2016)
Câu 67: Lưu huỳnh đioxit có thể tham gia phản ứng:
(1) SO2 + 2Mg 2MgO + S; (2) SO2+ Br2 + H2O 2HBr + H2SO4.
Tính chất của SO2 được diễn tả đúng nhất là
- SO2 thể hiện tính oxi hoá. B. SO2 thể hiện tính khử.
- SO2 vừa oxi hóa vừa khử. D. SO2 là oxit axit.
Câu 68: Cho phản ứng: SO2 + Cl2 + 2H2O 2HCl + H2SO4. Vai trò của lưu huỳnh đioxit là
- oxi hóa. B. vừa oxi hóa, vừa khử.
- khử. D. Không oxi hóa khử.
Câu 69: SO2 luôn thể hiện tính khử trong các phản ứng với
- H2S, O2, nước Br2.
- dung dịch NaOH, O2, dung dịch KMnO4.
- dung dịch KOH, CaO, nước Br2.
- O2, nước Br2, dung dịch KMnO4.
Câu 70: Cho các phản ứng hoá học sau, phản ứng nào không xảy ra với chất tan trong dung dịch?
- SO2 + dung dịch NaOH ® B. SO2 + dung dịch BaCl2 ®
- SO2 + dung dịch nớc clo ® D. SO2 + dung dịch H2S ®
(Đề thi thử THPT Việt Yên – Bắc Giang – Lần 4 – 2015)
Câu 71: Ở phản ứng nào sau đây, SO2 đóng vai trò chất oxi hoá?
- SO2 + Br2 + 2H2O 2HBr + H2SO4.
- 2SO2 + O2 2SO3.
- SO2 + 2H2S 3S + 2H2O.
- 5SO2 + 2KMnO4 + 2H2O K2SO4 + 2H2SO4 + 2MnSO4.
Câu 72: Cho phản ứng Al + H2SO4 đặc Al2(SO4)3 + SO2 + H2O. Hệ số cân bằng của H2SO4 là
- 4. B. 8. C. 6. D. 3.
Câu 73: Trong số những tính chất sau, tính chất nào không là tính chất của axit H2SO4 đặc nguội?
- Tan trong nước, tỏa nhiệt. B. Làm hóa than vải, giấy, đường.
- Hòa tan được kim loại Al và Fe. D. Háo nước.
Câu 74: Chất X tan trong nước và tác dụng được với dung dịch H2SO4 loãng. Chất X là chất nào sau đây?
- FeS. B. PbS. C. Na2S. D. CuS.
(Sở Giáo dục và Đào tạo Bắc Giang – 2016)
Câu 75: Cho FeCO3 tác dụng với H2SO4 đặc nóng dư. Sản phẩm khí thu được là
- CO2. B. H2 và CO2. C. SO2 và CO2. B. SO2.
Câu 76: Kim loại nào sau đây tác dụng với dung dịch H2SO4 loãng và dung dịch H2SO4 đặc nóng cho 2 loại muối khác nhau?
- Fe. B. Mg. C. Cu. D. Ag.
Câu 77: Cho các chất: Cu, CuO, BaSO4, Mg, KOH, C, Na2CO3. Tổng số chất tác dụng với dung dịch H2SO4 đặc, nóng là
- 4. B. 5. C. 6. D. 7.
3. Mức độ vận dụng
Câu 78: Cho lưu huỳnh lần lượt phản ứng với mỗi chất sau (trong điều kiện thích hợp): H2, O2, Hg, H2SO4 loãng, Al, Fe, F2, HNO3 đặc, nóng; H2SO4 đặc, nóng. Số phản ứng chứng minh được tính khử của lưu huỳnh?
- 5. B. 2. C. 4. D. 3.
Câu 79: Lưu huỳnh tác dụng với dung dịch kiềm nóng:
3S + 6KOH® 2K2S + K2SO3 + 3H2O.
Trong phản ứng này có tỉ lệ số nguyên tử S bị oxi hoá với số nguyên tử S bị khử là
- 2:1. B. 1:2. C. 1:3. D. 2:3.
Câu 80: Lưu huỳnh tác dụng với dung dịch H2SO4 đặc nóng:
S + 2H2SO4® 3SO2+ 2H2O.
Trong phản ứng này có tỉ lệ số nguyên tử S bị khử với số nguyên tử S bị oxi hoá là
- 2:1. B. 1:2. C. 1:3. D. 3:1.
Câu 81: Nung nóng hỗn hợp bột gồm 1,5 mol Fe và 1 mol S trong môi trường không có không khí đến khi phản ứng xảy ra hoàn toàn, thu được chất rắn X. X tác dụng với dung dịch HCl thu được khí Y. Thành phần của Y là
- H2. B. H2S và H2. C. H2S và SO2. D. H2S.
Câu 82: Cho các cặp chất sau: (a) HCl và H2S; (b) H2S và NH3 ; (c) H2S và Cl2 ; (d) H2S và N2. Có bao nhiêu cặp chất tồn tại trong hỗn hợp ở nhiệt độ thường?
- 1. B. 2. C. 3. D. 4.
Câu 83: Có các chất và dung dịch sau: NaOH (1), O2 (2), dung dịch Br2 (3), dung dịch CuCl2 (4), dung dịch FeCl2 (5). H2S có thể tham gia phản ứng với bao nhiêu chất?
- 2. B. 4. C. 3. D. 5.
Câu 84: Trong tự nhiên có rất nhiều nguồn sinh ra khí H2S như sự phân huỷ rác, chất thải… nhưng không có sự tích tụ H2S trong không khí. Nguyên nhân chính là
- H2S ở thể khí.
- H2S dễ bị oxi hóa trong không khí.
- H2S dễ bị phân huỷ trong không khí.
- H2S nặng hơn không khí.
Câu 85: Người ta thường dùng các vật dụng bằng bạc để cạo gió cho người bị trúng gió (khi người bị mệt mỏi, chóng mặt…do trong cơ thể tích tụ các khí độc như H2S…). Khi đó vật bằng bạc bị đen do phản ứng:
4Ag + O2 + 2H2S → 2Ag2S + 2H2O
Câu nào diễn tả đúng tính chất của các chất phản ứng?
- Ag là chất oxi hoá, H2S là chất khử.
- H2S là chất khử, O2 là chất oxi hoá.
- Ag là chất khử, O2 là chất oxi hoá.
- H2S vừa là chất oxi hoá, vừa là chất khử, Ag là chất khử.
Câu 86: Dẫn khí H2S vào dung dịch KMnO4 và H2SO4 loãng, hiện tượng quan sát được là:
- Dung dịch không màu chuyển sang màu tím.
- Dung dịch màu tím bị vẩn đục màu vàng.
- Màu tím của dung dịch KMnO4 chuyển sang màu vàng.
- Màu tím của dung dịch KMnO4 chuyển sang không màu và có vẩn đục màu vàng.
Câu 87: Cho phương trình phản ứng:
SO2 + KMnO4 + H2O → K2SO4 + MnSO4 + H2SO4
Sau khi cân bằng với hệ số là các giá trị tối giản, hệ số của chất oxi hoá và chất khử là
- 5 và 2. B. 2 và 5. C. 2 và 2. D. 5 và 5.
Câu 88: Cho sơ đồ phản ứng sau:
Các chất X, Y lần lượt là:
- SO2, hơi S. B. H2S, hơi S. C. H2S, SO2. D. SO2,H2S.
Câu 89: Cho các chất sau: O2(1), HCl(2), H2S(3), H2SO4 đặc(4), SO2(5). Số chất có khả năng làm mất màu dung dịch nước brom?
- 1. B. 2. C. 4. D. 3.
Câu 90: Khi nhiệt phân hoàn toàn m gam mỗi chất sau: KClO3 (xúc tác MnO2), KMnO4, KNO3 và AgNO3. Chất tạo ra lượng O2 lớn nhất là:
- KMnO4. B. KNO3. C. KClO3. D. AgNO3.
Câu 91: Thực hiện các phản ứng sau:
(a) 2KClO3 2KCl + 3O2.
(b) 2KMnO4 K2MnO4 + MnO2 + O2.
(c) 2H2O 2H2 + O2.
(d) 2Cu(NO3)2 2CuO + 4NO2 + O2.
Có bao nhiêu trường hợp thường dùng để điều chế oxi trong phòng thí nghiệm?
- 2. B. 4. C. 3. D. 5.
Câu 92: Oxi có thể thu được từ phản ứng nhiệt phân chất nào sau đây?
- KMnO4. B. NaHCO3. D. (NH4)2SO4. C. CaCO3.
Câu 93: Trong sản xuất, oxi được dùng nhiều nhất
- để làm nhiên liệu tên lửa. B. để luyện thép.
- trong công nghiệp hoá chất. D. để hàn, cắt kim loại.
Câu 94: Một chất dùng để làm sạch nước, dùng để chữa sâu răng và có tác dụng bảo vệ các sinh vật trên trái đất không bị bức xạ cực tím. Chất này là
- Ozon. B. Clo. C. Oxi. D. Flo.
Câu 95: Một trong những nguyên nhân chính gây ra sự suy giảm tầng ozon là do
- sự tăng nồng độ khí CO2. B. mưa axit.
- hợp chất CFC (freon). D. quá trình sản xuất gang thép.
(Sở Giáo dục và Đào tạo Bắc Giang – 2016)
Câu 96: Ứng dụng nào sau đây không phải của ozon?
- Tẩy trắng tinh bột, dầu ăn. B. Chữa sâu răng.
- Điều chế oxi trong phòng thí nghiệm. D. Sát trùng nước sinh hoạt.
Câu 97: Cho các ứng dụng:
(1) Được dùng để sát trùng nước sinh hoạt.
(2) Được dùng để chữa sâu răng.
(3) Tẩy trắng tinh bột, dầu ăn.
(4) Bảo quản trái cây chín.
Số ứng dụng của ozon là
- 2. B. 4. C. 1. D. 3.
Câu 98: Trái cây được bảo quản lâu hơn trong môi trường vô trùng. Trong thực tế, người ta sử dụng nước ozon để bảo quản trái cây. Ứng dụng trên dựa vào tính chất nào sau đây?
- Ozon trơ về mặt hóa học.
- Ozon là chất khí có mùi đặc trưng.
- Ozon là chất có tính oxi hóa mạnh.
- Ozon không tác dụng được với nước.
(Đề Tuyển sinh Đại học – khối B – năm 2014)
Câu 99: Nguy cơ nào có thể xảy ra khi tầng ozon bị thủng?
- Tia tử ngoại gây tác hại cho con người sẽ lọt xuống mặt đất.
- Không xảy ra đợc quá trình quang hợp của cây xanh.
- Không khí trên thế giới thoát ra ngoài.
- Thất thoát nhiệt trên toàn thế giới.
(Đề thi thử THPT Việt Yên – Bắc Giang – Lần 4 – 2015)
Link download bản pdf đầy đủ (188 câu)
CÂU HỎI TRẮC NGHIỆM OXI LƯU HUỲNH
Xem thêm
- Tổng hợp đề thi học kì 2 lớp 12 môn hóa học
- Tổng hợp đề thi học kì 2 lớp 11 môn hóa học
- Tổng hợp đề thi học kì 2 lớp 10 môn hoá học
- Tổng hợp các chuyên đề hóa học lớp 10
- Tổng hợp các chuyên đề hóa học lớp 11
- Tổng hợp các chuyên đề hóa học lớp 12
- Tổng hợp đề thi giữa học kì 2 cả ba khối 10 11 12
- Tổng hợp đề thi THPT QG 2021 file word có lời giải chi tiết
- Tổng hợp các phương pháp giải bài tập môn hoá học
- Tổng hợp đề thi HSG lớp 12 môn hoá học








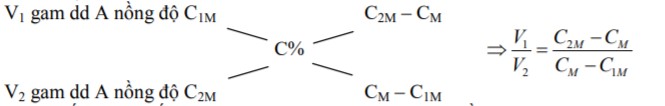
 Trộn V1 lít dd A nồng độ C1M với V2 lít dd A nồng độ C2M thu được (V1+V2) lít dd A nồng độ CM. (với C1M < CM < C2M)
Trộn V1 lít dd A nồng độ C1M với V2 lít dd A nồng độ C2M thu được (V1+V2) lít dd A nồng độ CM. (với C1M < CM < C2M)