Đề thi thử tốt nghiệp THPT môn Toán Sở GD Nam Định 2021
Quý thầy cô có thể tham khảo thêm Đề thi thử TN THPT môn hóa tỉnh Nam Định năm 2021 lần 2
I. Đề thi thử tốt nghiệp THPT môn Toán Sở GD Nam Định 2021
Câu 1: Từ các chữ số $1$, $2$, $3$, $4$, $5$ có thể lập được tất cả bao nhiêu số tự nhiên có $3$ chữ số đôi một khác nhau?
A. $40$. B. $120$. C. $60$. D. $6$.
Câu 2: Cho cấp số nhân $\left( {{u}_{n}} \right)$ với số hạng đầu ${{u}_{1}}=2$ và ${{u}_{2}}=-6$. Khi đó công bội $q$ bằng
A. $-3$ B. $3$ C. $-12$ D. $4$
Câu 3: Cho hàm số có bảng biến thiên như hình vẽ sau.
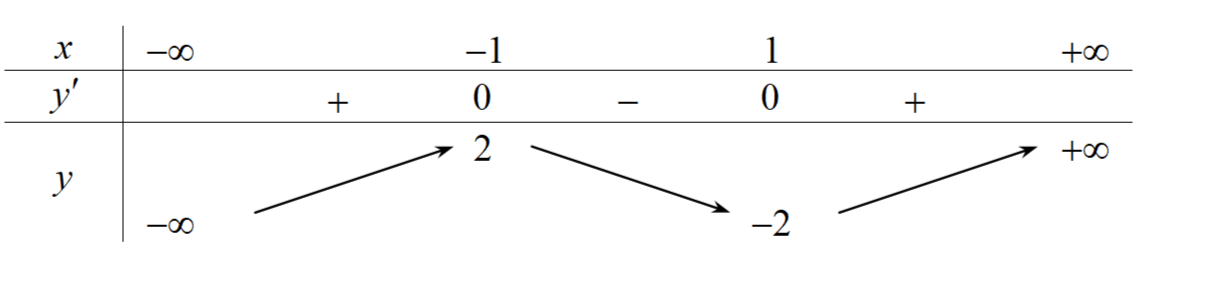
Hàm số đã cho đồng biến trên khoảng
A. $\left( -2\,;\,+\infty \right)$. B. $\left( -\infty \,;\,-1 \right)$. C. $\left( -\infty \,;\,2 \right)$. D. $\left( -2\,;\,2 \right)$.
Câu 4: Cho hàm số $y=f\left( x \right)$ có đồ thị như hình vẽ bên dưới.
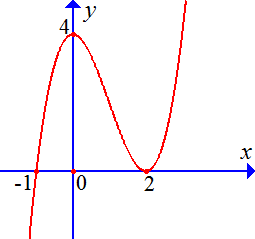
Mệnh đề nào sau đây đúng?
A. Hàm số đạt cực đại tại $x=2$. B. Hàm số đạt cực tiểu tại $x=2$.
C. Hàm số đạt cực đại tại $x=4$. D. Hàm số đạt cực tiểu tại $x=0$.
Câu 5: Chohàm số $y=f\left( x \right)$ liên tục trên $\mathbb{R}$ và có bảng xét dấu của ${f}’\left( x \right)$ như sau:
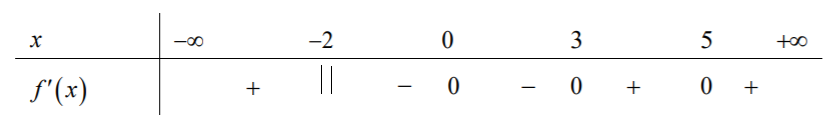
Số điểm cực đại của hàm số $y=f\left( x \right)$ là
A$0$. B. $1$. C. $3$. D. $2$.
Câu 6: Phương trình đường tiệm cận ngang của đồ thị hàm số $y=\frac{3-5x}{4x+7}$ là
A. $y=-\frac{5}{4}$. B. $x=\frac{3}{5}$. C. $y=\frac{3}{4}$. D. $x=-\frac{7}{4}$.
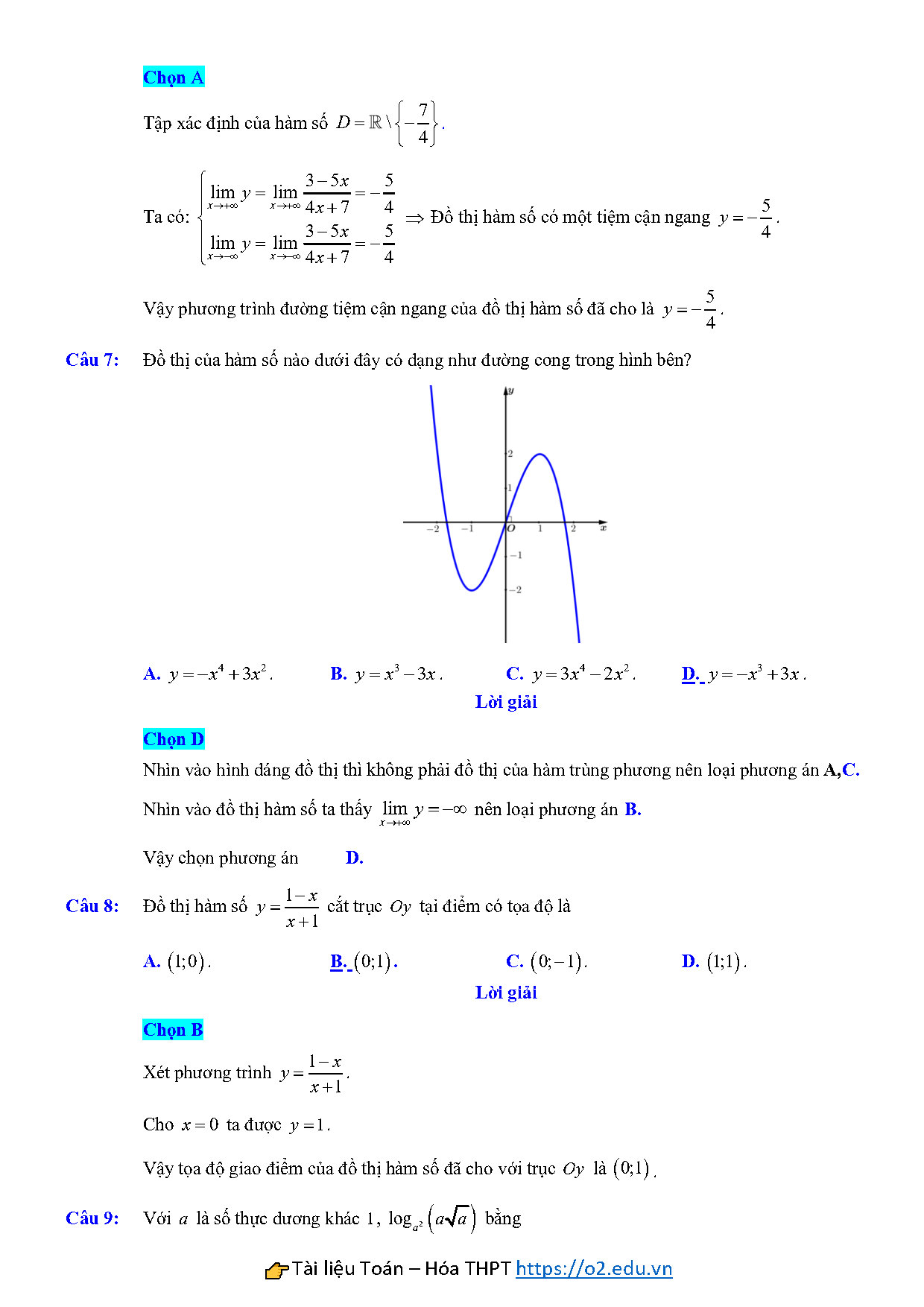
Câu 7: Đồ thị của hàm số nào dưới đây có dạng như đường cong trong hình bên?
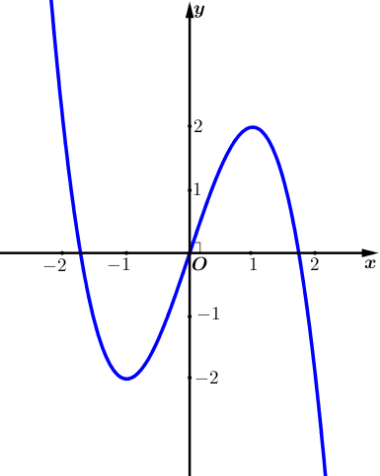
A. $y=-{{x}^{4}}+3{{x}^{2}}$. B. $y={{x}^{3}}-3x$. C. $y=3{{x}^{4}}-2{{x}^{2}}$. D. $y=-{{x}^{3}}+3x$.
Câu 8: Đồ thị hàm số $y=\frac{1-x}{x+1}$ cắt trục $Oy$ tại điểm có tọa độ là
A. $\left( 1;\,0 \right)$. B. $\left( 0;\,1 \right)$. C. $\left( 0;\,-1 \right)$. D. $\left( 1;\,1 \right)$.
Câu 9: Với $a$ là số thực dương khác $1$, ${{\log }_{{{a}^{2}}}}\left( a\sqrt{a} \right)$ bằng
A. $\frac{3}{4}$. B. $3$. C. $\frac{3}{2}$. D. $\frac{1}{4}$.
Câu 10: Hàm số $f\left( x \right)={{2}^{3x+4}}$ có đạo hàm là
A. ${f}’\left( x \right)={{3.2}^{3x+4}}.\ln 2$. B. ${f}’\left( x \right)={{2}^{3x+4}}.\ln 2$. C. ${f}’\left( x \right)=\frac{{{2}^{3x+4}}}{\ln 2}$. D. ${f}’\left( x \right)=\frac{{{3.2}^{3x+4}}}{\ln 2}$.
Câu 11: Với $x$ là số thực dương tùy ý, $\sqrt[3]{{{x}^{5}}\sqrt[4]{x}}$ bằng
A. ${{x}^{\frac{7}{4}}}$. B. ${{x}^{\frac{4}{7}}}$. C. ${{x}^{\frac{63}{4}}}$. D. ${{x}^{\frac{23}{12}}}$
Câu 12: Nghiệm của phương trình ${{3}^{x-2}}=9$ là
A. $x=-3$ B. $x=3$ C. $x=4$ D. $x=-4$
Câu 13: Nghiệm của phương trình ${{\log }_{2}}\left( x+7 \right)=5$ là
A. $x=39$. B. $x=18$. C. $x=25$. D. $x=3$
Câu 14: Họ nguyên hàm của hàm số $f\left( x \right)={{x}^{3}}-x+1$ là
A. $F\left( x \right)=\frac{{{x}^{4}}}{4}-\frac{{{x}^{2}}}{2}+x$. B. $F\left( x \right)=\frac{{{x}^{4}}}{4}-\frac{{{x}^{2}}}{2}+x+C$.
C. $F\left( x \right)=3{{x}^{2}}-1$. D. $F\left( x \right)={{x}^{4}}-{{x}^{2}}+x+C$.
Câu 15: Trong các khẳng định sau, đâu là khẳng định SAI?
A. $\int{{{e}^{x}}dx}=\frac{{{e}^{x+1}}}{x+1}+C$. B. $\int{dx}=x+C$.
C. $\int{{{x}^{e}}dx}=\frac{{{x}^{e+1}}}{e+1}+C$. D. $\int{\cos xdx}=\sin x+C$.
Câu 16: Cho $\int\limits_{1}^{2}{\left[ 4f\left( x \right)-2x \right]\text{d}x}=1$. Khi đó $\int\limits_{1}^{2}{f\left( x \right)}\text{d}x$ bằng
A. $4$. B. $-1$. C. $3$. D. $1$.
Câu 17: Tính tích phân $I=\int\limits_{-1}^{0}{\left( 2x+1 \right)\text{d}x}$.
A. $I=0$. B. $I=1$. C. $I=2$. D. $I=-\frac{1}{2}$.
Câu 18: Số phức nghịch đảo của $z=3+4i$ là
A. $3-4i$. B. $\frac{3}{25}-\frac{4}{25}i$. C. $\frac{3}{25}+\frac{4}{25}i$. D. $-3-4i$.
Câu 19: Cho hai số phức $z\,=\,1\,+\,3i$ và $w\,=\,1\,+\,i$. Môđun của số phức $z.\bar{w}$ bằng
A. $8$. B. $2\sqrt{5}$. C. $20$. D. $2\sqrt{2}$.
Câu 20: Trên mặt phẳng tọa độ $Oxy$, biết $M\left( -2\,;1 \right)$ là điểm biểu diễn số phức $z$. Phần thực của $z$ bằng
A. $-2$. B. $2$. C. $-1$. D. $1$.
Câu 21: Cho khối lăng trụ có diện tích đáy $B=3$ và chiều cao $h=4$. Thể tích của khối lăng trụ đã cho bằng
A. $6$. B. $12$. C. $36$. D. $4$.
Câu 22: Thể tích của khối chóp có chiều cao bằng $a$ và diện tích đáy $2{{a}^{2}}$ là
A. ${{a}^{3}}$. B. $\frac{2{{a}^{3}}}{3}$. C. $\frac{{{a}^{3}}}{3}$. D. $2{{a}^{3}}$.
Câu 23: Thể tích của hình trụ có đường cao và đường kính đáy đều bằng $2a$ là
A. $6\pi {{a}^{3}}$. B. $8\pi {{a}^{3}}$. C. $4\pi {{a}^{3}}$. D. $2\pi {{a}^{3}}$.
Câu 24: Cắt hình trụ $\left( T \right)$ bởi một mặt phẳng đi qua trục của nó, ta được thiết diện là một hình vuông cạnh bằng $7$. Diện tích xung quanh của $\left( T \right)$ bằng
A. $\frac{49\pi }{2}$. B. $49\pi $. C. $98\pi $. D. $\frac{49\pi }{4}$.
Câu 25: Trong không gian $Oxyz$, hình chiếu vuông góc của $M\left( 1;3;5 \right)$ lên mặt phẳng tọa độ $\left( Oxy \right)$ là điểm có tọa độ
A. $\left( 1;3;0 \right)$. B. $\left( 1;0;5 \right)$. C. $\left( 0;3;5 \right)$. D. $\left( 0;0;5 \right)$.
Câu 26: Trong không gian với hệ trục tọa độ $Oxyz$, xác định tọa độ tâm $I$ của mặt cầu $\left( S \right):\,{{x}^{2}}+{{y}^{2}}+{{z}^{2}}-4x+2y-8z=0$.
A. $I\left( -2;\,1;\,-4 \right)$. B. $I\left( -4;\,2;\,-8 \right)$. C. $I\left( 2;\,-1;\,4 \right)$. D. $I\left( 4;\,-2;\,8 \right)$.
Câu 27: Trong không gian với hệ trục tọa độ $Oxyz$, cho mặt phẳng $\left( P \right):2x+3y-z+1=0$. Điểm nào dưới đây không thuộc mặt phẳng $\left( P \right)$?
A. $B\left( 1;2;-8 \right)$. B. $C\left( -1;-2;-7 \right)$. C. $A\left( 0;0;1 \right)$. D. $D\left( 1;5;18 \right)$.
Câu 28: Trong không gian $Oxyz$, một véctơ chỉ phương của đường thẳng $\Delta :\frac{x}{1}=\frac{y}{2}=\frac{4-z}{-3}$ là:
A. $\overrightarrow{u}=\left( 0;0;4 \right)$. B. $\overrightarrow{u}=\left( 1;2;3 \right)$. C. $\overrightarrow{u}=\left( 1;-2;3 \right)$. D. $\overrightarrow{u}=\left( 1;2;-3 \right)$.
Câu 29: Trên giá sách có $4$ quyển sách Toán, 3 quyển sách Văn, $2$ quyển sách Tiếng Anh (các quyển sách đôi một khác nhau). Lấy ngẫu nhiên $3$ quyển sách. Tính xác suất để trong ba quyển sách lấy ra có ít nhất một quyển là Toán.
A. $\frac{2}{7}.$ B. $\frac{3}{4}.$ C. $\frac{37}{42}.$ D. $\frac{10}{21}.$
Câu 30: Hàm số nào dưới đây đồng biến trên khoảng $\left( -\infty ;+\infty \right)$?
A. $y=-{{x}^{3}}-3x$. B. $y=\frac{x-1}{x-2}$. C. $y=\frac{x+1}{x+3}$. D. $y={{x}^{3}}+3x$.
Câu 31: Gọi $M,\,m$ lần lượt là giá trị lớn nhất, nhỏ nhất của hàm số $y=-{{x}^{3}}+3{{x}^{2}}-1$ trên đoạn $\left[ -3;1 \right]$. Tổng $M+m$ bằng
A. $0$. B. $54$. C. $-3$. D. $52$.
Câu 32: Tìm số nghiệm nguyên của bất phương trình ${{\log }_{\frac{1}{3}}}\left( 4x-9 \right)>{{\log }_{\frac{1}{3}}}\left( x+10 \right)$.
A. $5$. B. $4$. C. $0$. D. Vô số.
Câu 33: Cho hàm số $f\left( x \right)$ liên tục trên $\mathbb{R}$ thỏa mãn $\int\limits_{1}^{2}{f\left( x \right)\text{d}x=3}$, $\int\limits_{2}^{2021}{f\left( x \right)\text{d}x=-1}$ thì $\int\limits_{1}^{2021}{f\left( x \right)\text{d}x\,}$bằng
A. $-2$. B. $2$. C. $3$. D. $4$.
Câu 34: Cho số phức $\left( 1-i \right)z=4+2i$. Tìm môđun của số phức $w=z+3$.
A. $5$. B. $\sqrt{10}$. C. $25$. D. $\sqrt{7}$.
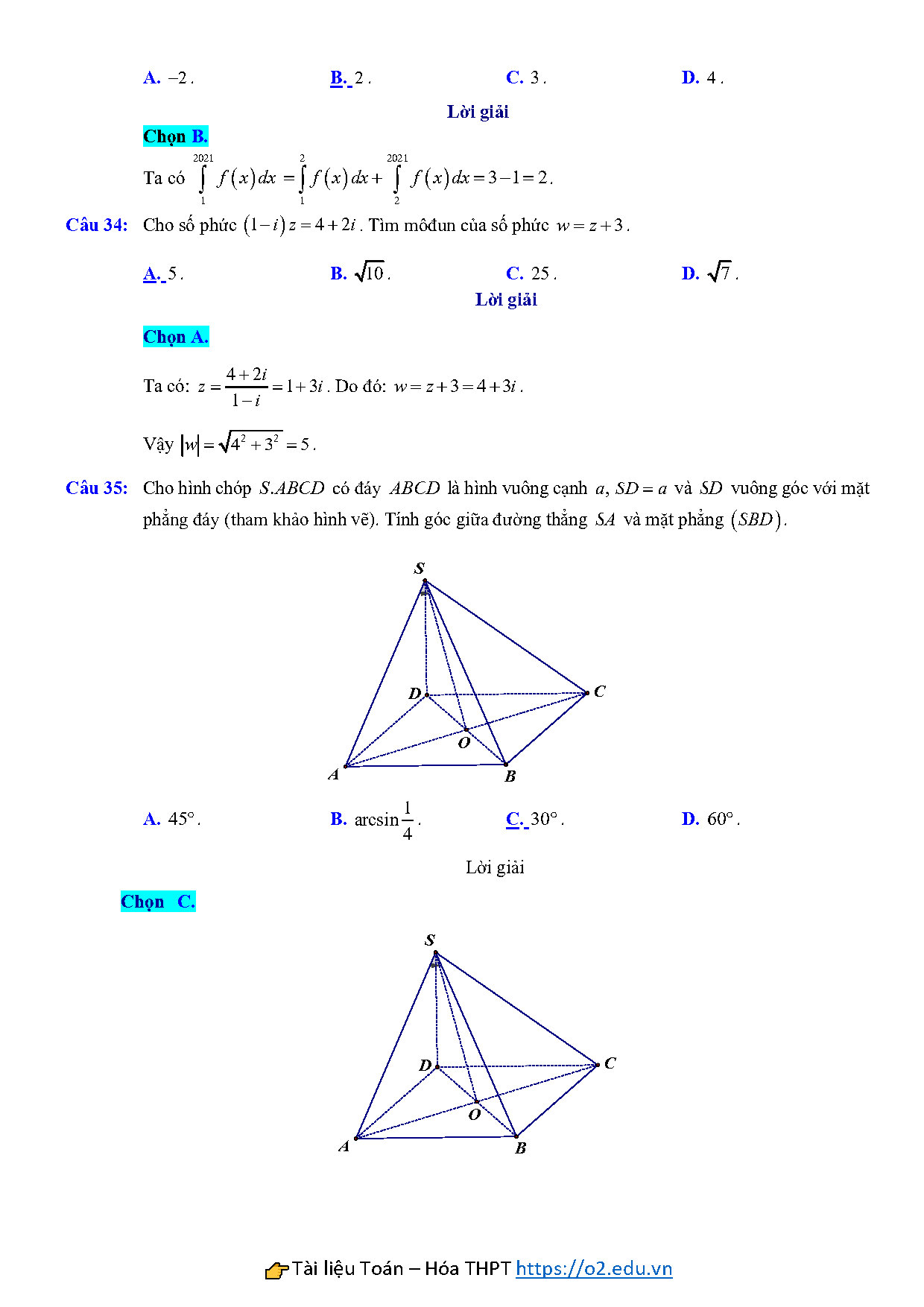
Câu 35: Cho hình chóp $S.ABCD$ có đáy $ABCD$ là hình vuông cạnh $a,\,\,SD=a$ và $SD$ vuông góc với mặt phẳng đáy (tham khảo hình vẽ). Tính góc giữa đường thẳng $SA$ và mặt phẳng $\left( SBD \right)$.
A. $45^\circ $. B. $\arcsin \frac{1}{4}$. C. $30{}^\circ $. D. $60{}^\circ $.
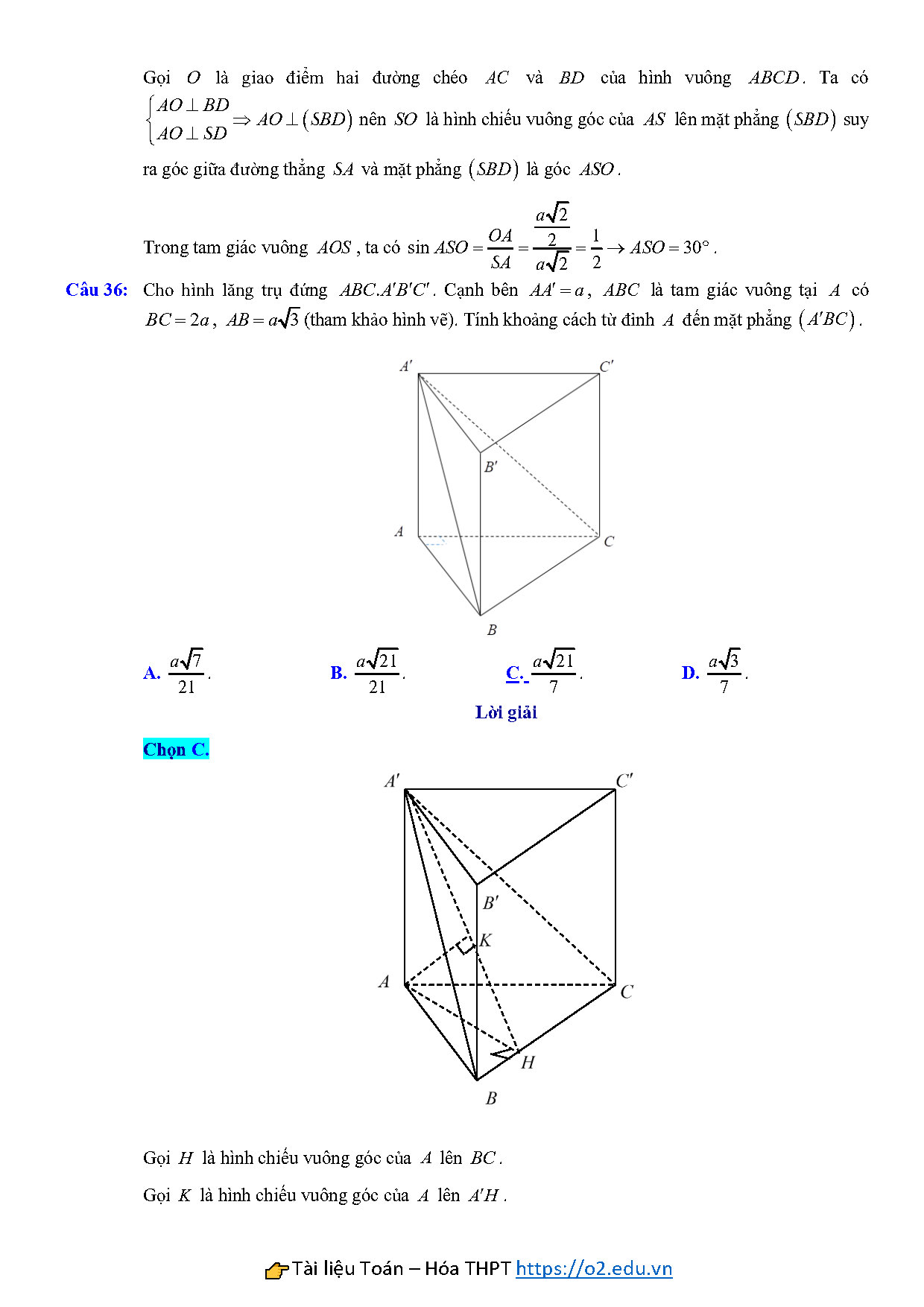
Câu 36: Cho hình lăng trụ đứng $ABC.{A}'{B}'{C}’$. Cạnh bên $A{A}’=a$, $ABC$ là tam giác vuông tại $A$ có $BC=2a$, $AB=a\sqrt{3}$(tham khảo hình vẽ). Tính khoảng cách từ đỉnh $A$ đến mặt phẳng $\left( {A}’BC \right)$.
A. $\frac{a\sqrt{7}}{21}$. B. $\frac{a\sqrt{21}}{21}$.$$ C. $\frac{a\sqrt{21}}{7}$. D. $\frac{a\sqrt{3}}{7}$.
Câu 37: Mặt cầu $\left( S \right)$ có tâm $I\left( -1;2;1 \right)$ và tiếp xúc với mặt phẳng $\left( P \right)$: $x-2y-2z-2=0$ có phương trình là
A. $\left( S \right)$: ${{\left( x+1 \right)}^{2}}+{{\left( y-2 \right)}^{2}}+{{\left( z-1 \right)}^{2}}=3$. B. $\left( S \right)$:${{\left( x+1 \right)}^{2}}+{{\left( y-2 \right)}^{2}}+{{\left( z+1 \right)}^{2}}=3$.
C. $\left( S \right)$: ${{\left( x-1 \right)}^{2}}+{{\left( y+2 \right)}^{2}}+{{\left( z+1 \right)}^{2}}=9$. D. $\left( S \right)$:${{\left( x+1 \right)}^{2}}+{{\left( y-2 \right)}^{2}}+{{\left( z-1 \right)}^{2}}=9$.
Câu 38: Trong không gian với hệ tọa độ $Oxyz$, đường thẳng đi qua hai điểm $A\left( 1;\,1;\,2 \right)$, $B\left( 2;\,-1;\,3 \right)$ có phương trình chính tắc là
A. $\frac{x-1}{3}=\frac{y-1}{2}=\frac{z-2}{1}$. B. $\frac{x-1}{1}=\frac{y-1}{-2}=\frac{z-2}{1}$.
C. $\frac{x-3}{1}=\frac{y+2}{1}=\frac{z-1}{2}$. D. $\frac{x+1}{3}=\frac{y+1}{-2}=\frac{z+2}{1}$.
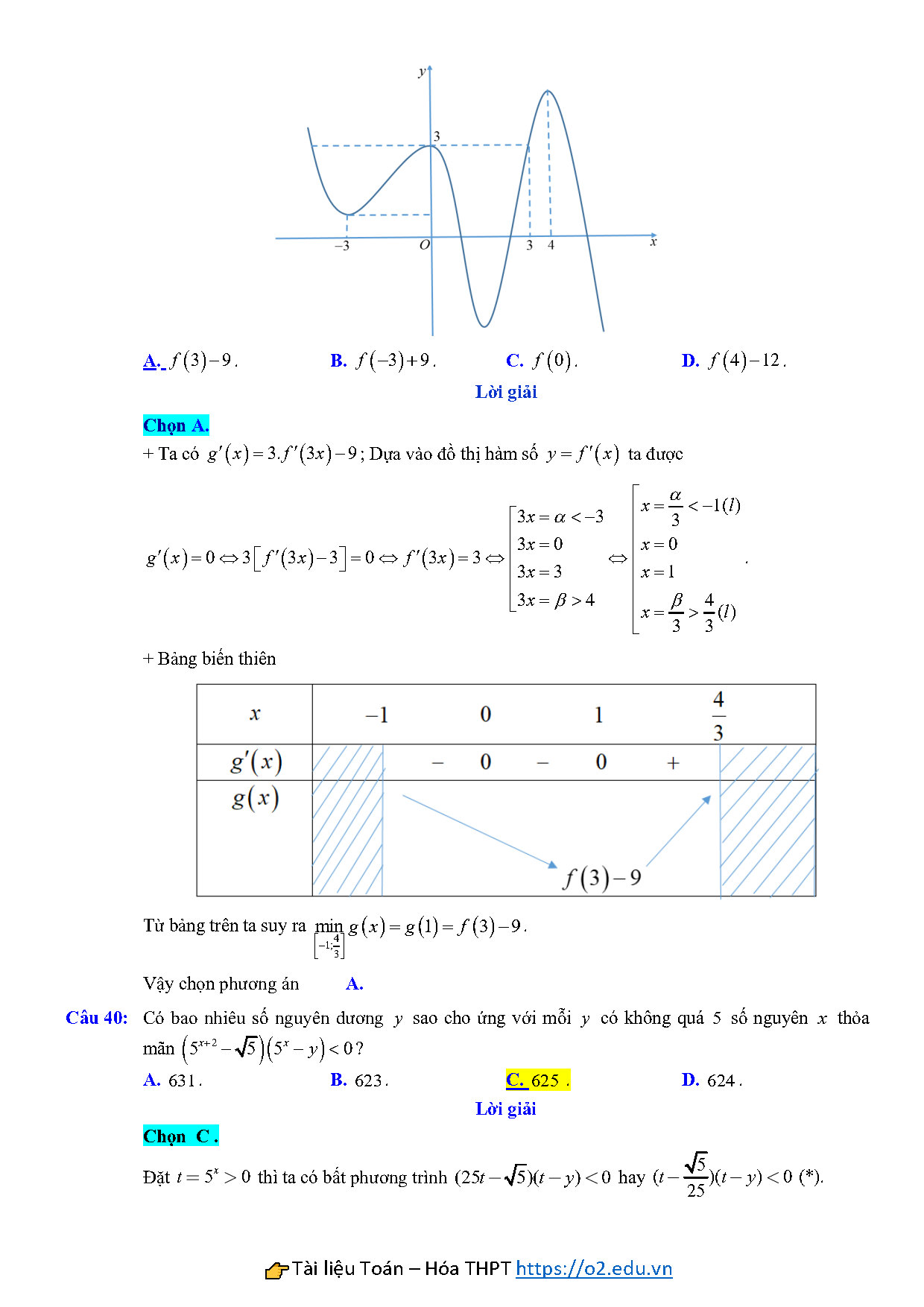
Câu 39: Cho hàm số $f\left( x \right)$, đồ thị của hàm số $y={f}’\left( x \right)$ là đường cong trong hình vẽ bên. Giá trị nhỏ nhất của hàm số $g\left( x \right)=f\left( 3x \right)-9x$ trên đoạn $\left[ -1;\frac{4}{3} \right]$ bằng
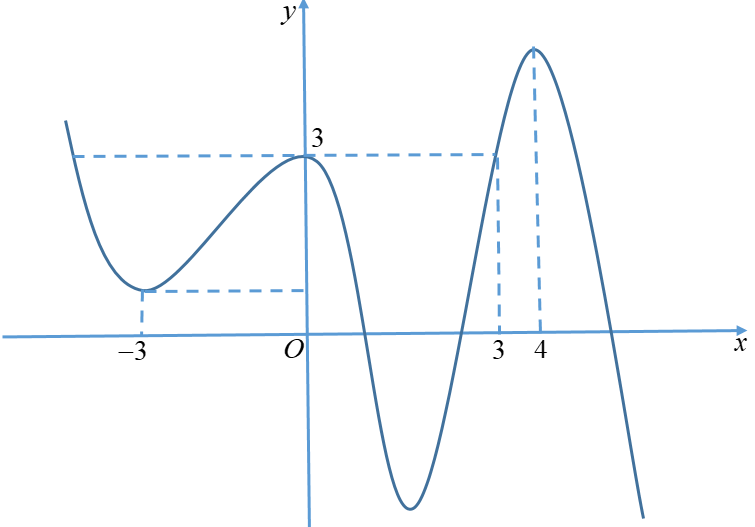
A. $f\left( 3 \right)-9$. B. $f\left( -3 \right)+9$. C. $f\left( 0 \right)$. D. $f\left( 4 \right)-12$.
Câu 40: Có bao nhiêu số nguyên dương $y$ sao cho ứng với mỗi $y$ có không quá $5$ số nguyên $x$ thỏa mãn $\left( {{5}^{x+2}}-\sqrt{5} \right)\left( {{5}^{x}}-y \right)<0$?
A. $631$. B. $623$. C. $625$ . D. $624$.
Câu 41: Cho hàm số $f( x )= \begin{cases} x+1\text{ khi }x\le 2 \\ {{x}^{2}}-1\text{ khi }x>2 \end{cases}$. Giá trị của tích phân $\int\limits_{1}^{e}{\frac{f\left( 1+2\ln x \right)}{x}dx}$ bằng
A. $\frac{31}{6}$ B. $\frac{47}{12}$ C. $\frac{47}{6}$ D. $\frac{79}{12}$
Câu 42: Có bao nhiêu số phức $z$ thỏa mãn điều kiện $\left| z \right|\left( z+2 \right)+10=15i$?
A. $1$ B. $2$ C. $3$ D. $4$
Câu 43: Cho hình chóp $S.ABC$ có mặt đáy làm tam giác vuông cân tại $A$, $AB=1$, đường thẳng $SA$ vuông góc với mặt phẳng chứa đáy. Gọi $M$ là trung điểm của cạnh $AB$, góc giữa mặt phẳng $\left( SBC \right)$ và mặt phẳng $\left( SMC \right)$ bằng $\varphi $ thỏa mãn $\sin \varphi =\frac{1}{3}$. Tính thể tích của khối chóp $S.ABC$.
A. $\frac{1}{6}$ B. $\frac{1}{3}$ C. $\frac{2}{3}$ D. $\frac{\sqrt{3}}{6}$
Câu 44: Cho hình chóp $S.ABC$ có $SA=SB=SC=a\sqrt{3}$, mặt đáy $ABC$ là tam giác cân tại $A$ với $AB=a,\widehat{BAC}={{120}^{0}}$ ($a$ là số dương cho trước). Diện tích của mặt cầu ngoại tiếp hình chóp $S.ABC$ là
A. $9\pi {{a}^{2}}$ B. $\frac{9\pi {{a}^{2}}}{8}$ C. $\frac{9\pi {{a}^{2}}}{2}$ D. $3\pi {{a}^{2}}$
Câu 45: Trong không gian tọa độ $Oxyz$, cho mặt phẳng $\left( P \right):2x+2y-z-3=0$, đường thẳng $d:\frac{x+1}{1}=\frac{y-1}{1}=\frac{z}{2}$ và điểm $A\left( 2;2;-1 \right)$. Gọi $\Delta $ là đường thẳng đi qua điểm $A$, cắt đường thẳng $d$ và song song với mặt phẳng $\left( P \right)$. Phương trình của đường thẳng $\Delta $ là
A. $\frac{x+2}{3}=\frac{y+2}{7}=\frac{z-1}{20}$ B. $\frac{x-2}{3}=\frac{y-2}{7}=\frac{z+1}{20}$
C. $\frac{x+2}{2}=\frac{y+2}{-3}=\frac{z-1}{-2}$ D. $\frac{x-2}{3}=\frac{y-2}{-3}=\frac{z+1}{-2}$
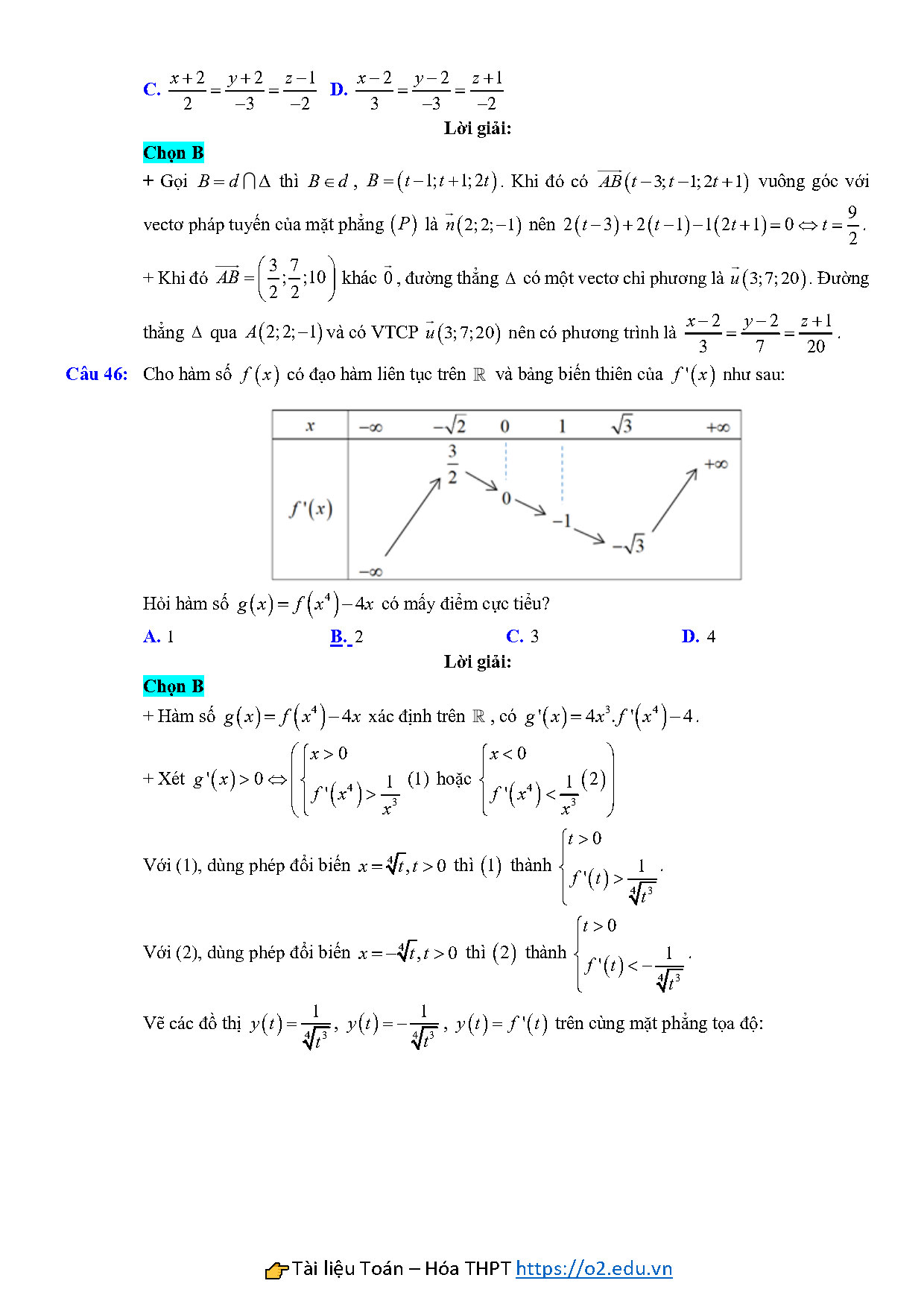
Câu 46: Cho hàm số $f\left( x \right)$ có đạo hàm liên tục trên $\mathbb{R}$ và bảng biến thiên của $f’\left( x \right)$ như sau:
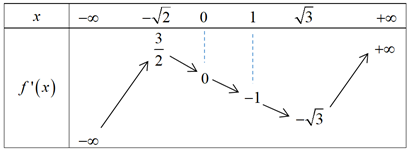
Hỏi hàm số $g\left( x \right)=f\left( {{x}^{4}} \right)-4x$ có mấy điểm cực tiểu?
A. $1$ B. $2$ C. $3$ D. $4$
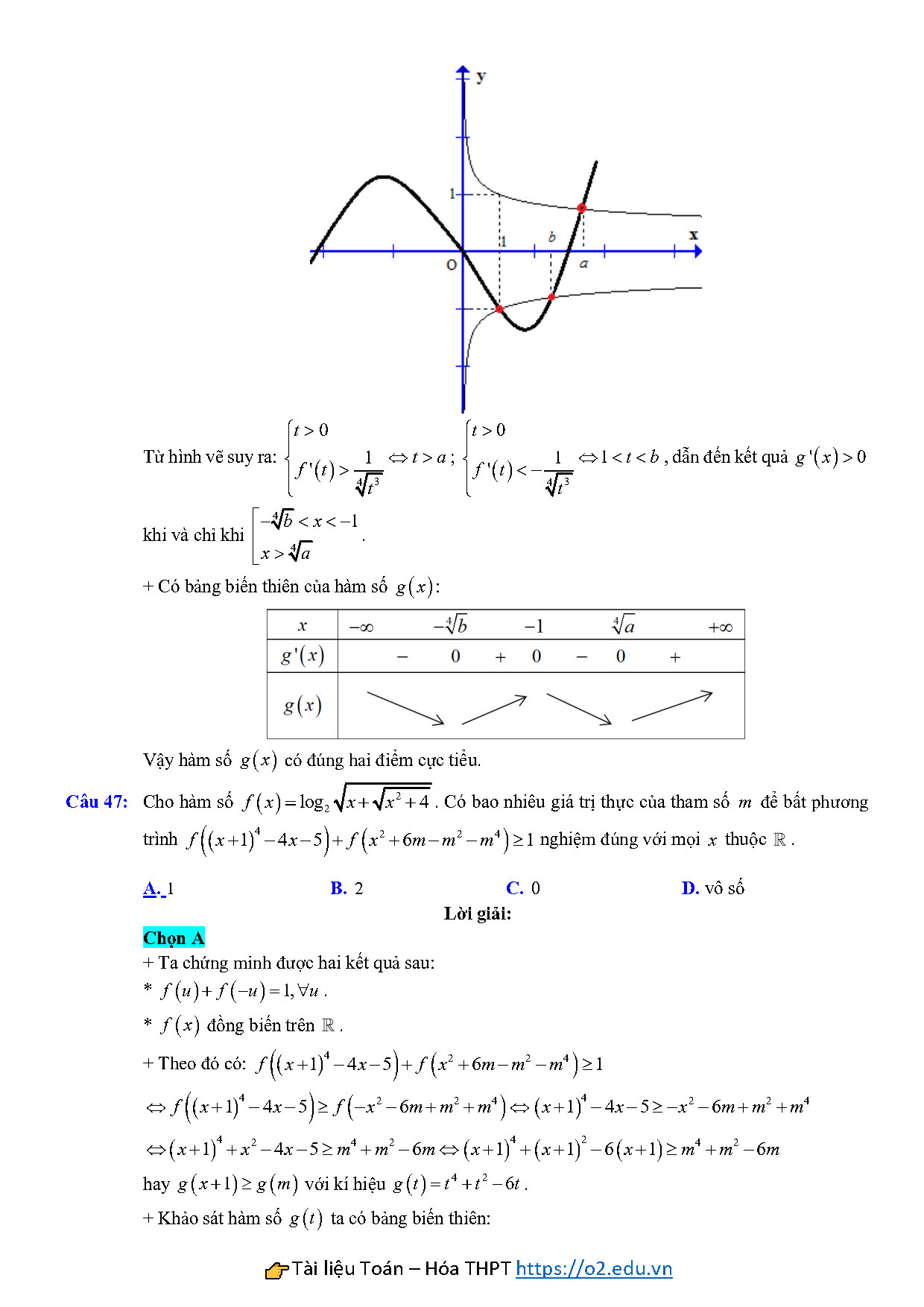
Câu 47: Cho hàm số $f\left( x \right)={{\log }_{2}}\sqrt{x+\sqrt{{{x}^{2}}+4}}$. Có bao nhiêu giá trị thực của tham số $m$ để bất phương trình $f\left( {{\left( x+1 \right)}^{4}}-4x-5 \right)+f\left( {{x}^{2}}+6m-{{m}^{2}}-{{m}^{4}} \right)\ge 1$ nghiệm đúng với mọi $x$ thuộc $\mathbb{R}$.
A. $1$ B. $2$ C. $0$ D. vô số
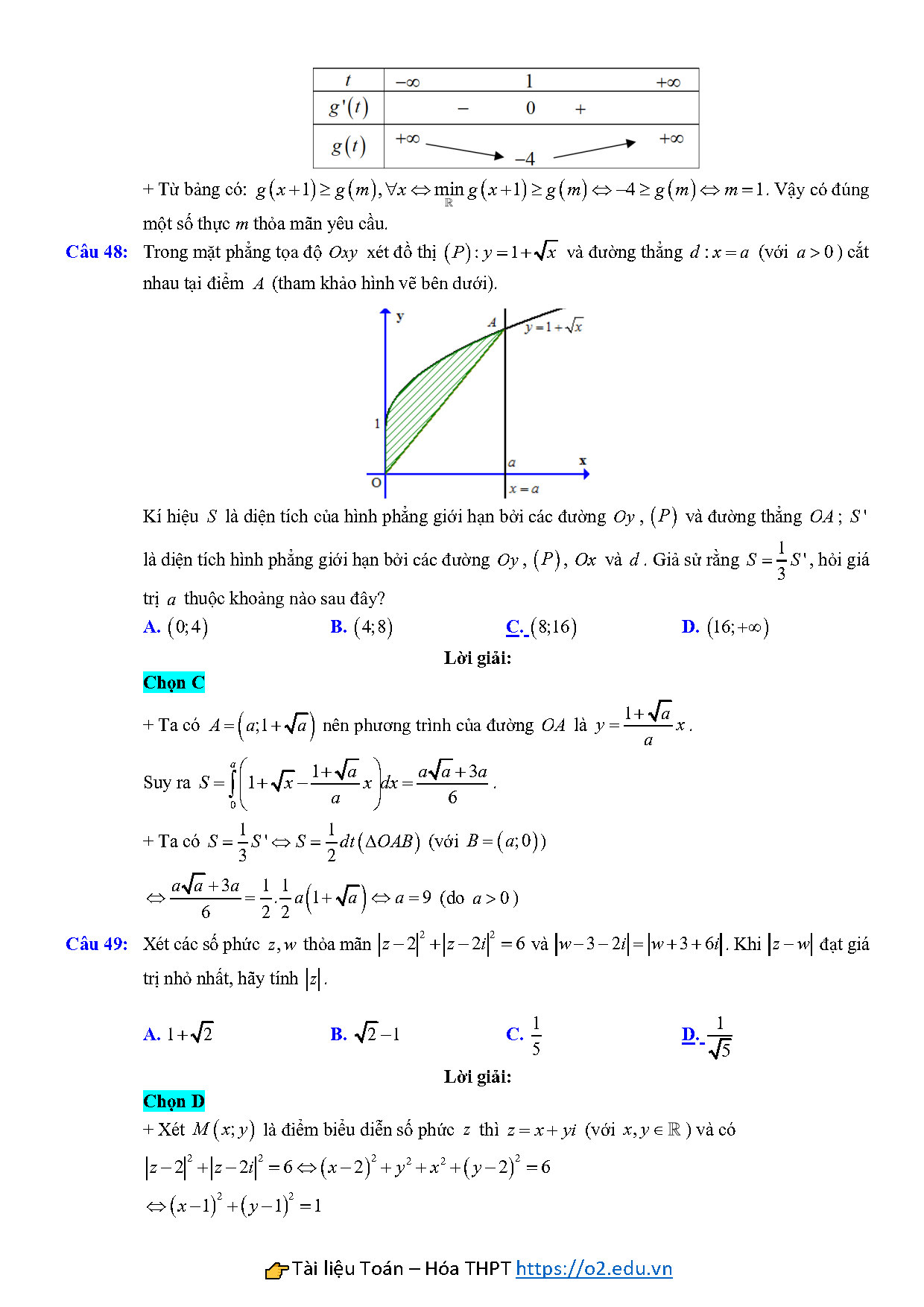
Câu 48: Trong mặt phẳng tọa độ $Oxy$ xét đồ thị $\left( P \right):y=1+\sqrt{x}$ và đường thẳng $d:x=a$ (với $a>0$) cắt nhau tại điểm $A$ (tham khảo hình vẽ bên dưới).

Kí hiệu $S$ là diện tích của hình phẳng giới hạn bởi các đường $Oy$, $\left( P \right)$ và đường thẳng $OA$; $S’$ là diện tích hình phẳng giới hạn bởi các đường $Oy$, $\left( P \right)$, $Ox$ và $d$. Giả sử rằng $S=\frac{1}{3}S’$, hỏi giá trị $a$ thuộc khoảng nào sau đây?
A. $\left( 0;4 \right)$ B. $\left( 4;8 \right)$ C. $\left( 8;16 \right)$ D. $\left( 16;+\infty \right)$
Câu 49: Xét các số phức $z,w$ thỏa mãn ${{\left| z-2 \right|}^{2}}+{{\left| z-2i \right|}^{2}}=6$ và $\left| w-3-2i \right|=\left| w+3+6i \right|$. Khi $\left| z-w \right|$ đạt giá trị nhỏ nhất, hãy tính $\left| z \right|$.
A. $1+\sqrt{2}$ B. $\sqrt{2}-1$ C. $\frac{1}{5}$ D. $\frac{1}{\sqrt{5}}$
Câu 50: Trong không gian tọa độ $Oxyz$, cho hai mặt cầu $\left( {{S}_{1}} \right):{{x}^{2}}+{{\left( y-1 \right)}^{2}}+{{\left( z-2 \right)}^{2}}=16$, $\left( {{S}_{2}} \right):{{\left( x-1 \right)}^{2}}+{{\left( y+1 \right)}^{2}}+{{z}^{2}}=1$ và điểm $A\left( \frac{4}{3};\frac{7}{3};-\frac{14}{3} \right)$. Gọi $I$ là tâm của mặt cầu $\left( {{S}_{1}} \right)$ và $\left( P \right)$ là mặt phẳng tiếp xúc với cả hai mặt cầu $\left( {{S}_{1}} \right)$ và $\left( {{S}_{2}} \right)$. Xét các điểm $M$ thay đổi và thuộc mặt phẳng $\left( P \right)$ sao cho đường thẳng $IM$ tiếp xúc với mặt cầu $\left( {{S}_{2}} \right)$. Khi đoạn thẳng $AM$ ngắn nhất thì $M=\left( a;b;c \right)$. Tính giá trị của $T=a+b+c$.
A. $T=1$ B. $T=-1$ C. $T=\frac{7}{3}$ D. $T=-\frac{7}{3}$
II. Hướng dẫn giải Đề thi thử tốt nghiệp THPT môn Toán Sở GD Nam Định 2021
Quý thầy cô tải file PDF tại đây Loi giai de thi thu TNTHPT mon Toan SGD Nam Dinh 2021